工程化为体内产生血清素的先进微生物组疗法
1.本发明提供了一种用作药物的组合物,所述组合物包括重组微生物的细胞,所述细胞能够产生相较于所述细胞源自的非重组微生物增加量的5-羟色氨酸(5-htp)、5-羟色胺(5-ht)和色胺(trm)中的一种或多种。所述组合物可用于预防和/或治疗哺乳动物的trm、5-htp或5-ht相关的以下病症:中枢神经系统(cns)病症;肠内神经系统(ens)病症;胃肠道(gi)病症和代谢病症,并且所述组合物可以口服施用于有需要的哺乳动物。另外,提供了一种包括能够产生褪黑素的重组微生物的细胞的组合物,以用作药物。
背景技术:
2.生物源性单胺血清素(5-羟色胺,5-ht)对神经传递和整个身体的许多其它功能至关重要。身体中至多95%的血清素在胃肠道中产生。血清素是从色氨酸(trp)通过两步反应得到的,首先是通过色氨酸羟化酶(tph)以形成5-羟色氨酸(5-htp)中间体,并且然后通过色氨酸脱羧酶(tdc),如图1所示。在人体内,色氨酸羟化酶是5-ht生物合成的速率限制步骤并且以两种异构体tph1和tph2形式制成。tph2是在整个身体内的神经元中产生的,而tph1主要在肠道的神经内分泌细胞中进行表达。
3.在gi道中,血清素调节肠运动、细胞周转和内稳态。在脑中,血清素水平的不平衡与焦虑和抑郁有关。治疗包含用于升高患有各种焦虑和抑郁相关的疾病中的任何疾病的患者的血清素的策略。
4.针对抑郁的治疗,开出了选择性血清素再摄取抑制剂(ssri)的处方。据信,所述抑制剂可通过限制神经递质血清素再吸收(再摄取)到突触前细胞中,增加突触间隙中可供与突触后受体结合的血清素的水平,来增加神经递质血清素的细胞外水平。一小组患者呈现出ssri治疗抗性(trd)的症状。目前在临床试验下在哺乳动物模型中,对trd患者的治疗基于ssri(血清素再摄取抑制剂)和血清素前体5-羟色氨酸(5-htp)的组合疗法。这由于所施用的5-htp的快速摄取而产生不期望的后果,从而导致5-ht水平突然升上尖峰。目前解决这个问题所做的努力集中在采用缓释5-htp形式的组合疗法上。
5.肠细菌在胃肠(gi)健康和内稳态中起着至关重要的作用。除了调节肠道内稳态外,肠微生物被认为参与肠内神经系统(ens)和中枢神经系统(cns)沿肠道-脑轴线的双向信号传导通路。已知的是肠道中的常驻微生物群会向宿主粘膜内分泌细胞发送信号以维持肠道5-ht含量和5-ht血浆水平,而不是其自身供应大量5-ht。最近,已经显示动物模型中口服摄入某些细菌会导致宿主生理和行为变化,这暗示了这些微生物在肠道-脑通信中的作用。
6.在脑的海马、纹状体、皮层和齿状回中,基于血清素的生物合成通路、基于血清素的受体和基于血清素的信号传导通路涉及记忆、认知/年龄相关的空间学习和记忆形成。因为来自胃肠道的羟色胺能传入神经元通过迷走神经改变迷走神经的背运动核和孤束核,所以肠5-ht涉及神经元记忆、认知和学习。
7.鉴于trm和5-ht在哺乳动物内稳态和由5-ht水平不足引起的医学状况中的关键作
用,需要新的治疗来升高患者,尤其是患有焦虑相关的疾病以及trd的那些患者的5-ht的水平。
8.信号传导分子褪黑素是一种高度多向性的分子,其主要在夜间以松果体的激素的形式释放。褪黑素分泌在衰老期间会减少,但在各种疾病,如各种类型的痴呆症、某些情绪障碍、剧烈疼痛、癌症和2型糖尿病中也观察到褪黑素水平降低。褪黑素功能障碍通常与昼夜节律的幅度、分相和偶联的偏差有关。因此,需要会升高有需要的患者的褪黑素水平的治疗。
技术实现要素:
9.在第一实施例中,本发明提供了一种用作药物的组合物,其中所述组合物包括重组微生物的细胞,并且其中所述微生物包括对选自以下的多种蛋白质之一进行编码的一种或多种重组核酸分子:
10.(a)色氨酸5-羟化酶(ec 1.14.16.4);
11.(b)色氨酸脱羧酶(ec 4.1.1.28);以及
12.(c)色胺5-羟化酶(ec:1.14.-.-)。
13.因此,所述细胞能够产生相较于细胞源自的非重组微生物的细胞,增加量的5-羟色氨酸、5-羟色胺和色胺中的一种或多种。
14.在第二实施例中,本发明提供了一种重组细菌细胞,所述重组细菌细胞包括对选自以下的多种蛋白质之一进行编码的一种或多种重组核酸分子或转基因:
15.(a)色氨酸5-羟化酶(ec 1.14.16.4);
16.(b)色氨酸脱羧酶(ec 4.1.1.28);以及
17.(c)色胺5-羟化酶(ec:1.14.-.-),
18.其中所述微生物缺乏能够表达
19.trp操纵子阻遏蛋白和色氨酸酶的基因(ec:4.1.99.1)。所述细胞因此能够产生相较于细胞源自的非重组微生物的细胞增加量的5-羟色氨酸、5-羟色胺和色胺中的一种或多种。
20.优选地,所述重组细菌细胞选自:埃希氏杆菌属(escherichia)、拟杆菌属(bacteroides)、梭菌属(clostridium)、栖粪杆菌属(feacalibacterium)、真杆菌属(eubacterium)、瘤胃球菌属(ruminococcus)、消化球菌属(peptococcus)、消化链球菌属(peptostreptococcus)、乳杆菌属(lactobacillus)、乳球菌属(lactococcus)、双歧杆菌属(bifidobacterium)、肠球菌属(enterococcus)、链球菌属(streptococcus)、片球菌属(pediococcus)、明串珠菌属(leuconostoc)、葡萄球菌属(staphylococcus)和芽孢杆菌属(bacillus)。
21.在第三实施例中,本发明提供了一种用于预防和/或治疗受试者的trm、5-htp、5-ht、或褪黑素相关的病症的方法,所述方法包括向诊断患有trm、5-htp、5-ht、或褪黑素相关的病症的受试者施用重组细菌,所述重组细菌被工程化为表达以下中的一种或多种:
22.(a)色氨酸5-羟化酶(ec 1.14.16.4);
23.(b)色氨酸脱羧酶(ec 4.1.1.28);或
24.(c)色胺5-羟化酶(ec:1.14.-.-)。
25.因此,所述细胞能够产生相较于细胞源自的非重组微生物的细胞,增加量的5-羟色氨酸、5-羟色胺和色胺中的一种或多种。
26.所述trm、5-htp、5-ht、或褪黑素相关的病症可以是哺乳动物的以下病症:中枢神经系统(cns)病症;肠内神经系统(ens)病症;胃肠道(gi)病症和代谢病症。
27.在第四实施例中,本发明提供了一种重组微生物,所述重组微生物包括一种或多种重组核酸分子或转基因,
28.其中所述微生物包括:对以下进行编码的重组核酸分子:
29.(a)色氨酸5-羟化酶(ec 1.14.16.4)和色氨酸脱羧酶(ec 4.1.1.28);或
30.(b)色氨酸脱羧酶(ec 4.1.1.28)和色胺5-羟化酶(ec:1.14.-.-);以及
31.对以下进行编码的重组核酸分子:
32.(c)血清素乙酰转移酶(aanat)ec 2.3.1.87和
33.(d)乙酰血清素o-甲基转移酶(asmt)(ec 2.1.1.4),
34.其中所述细胞能够产生褪黑素。所述细胞因此能够产生相较于细胞源自的非重组微生物的细胞,在量方面增加的褪黑素。
35.在第五实施例中,本发明提供了一种用作药物的组合物,其中所述组合物包括根据第四实施例的重组微生物的细胞,所述细胞:能够产生褪黑素;适用于患有褪黑素缺乏症或褪黑素相关的病症的患者的口服递送,如以下褪黑素相关的病症:昼夜节律紊乱、失眠、时差、自闭症;痴呆症、情绪障碍、剧烈疼痛、癌症和2型糖尿病。
36.描述
附图说明
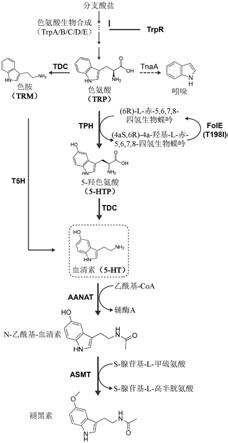
37.图1草图,其示出5-ht和褪黑素生物合成通路的催化步骤。trpr(色氨酸操纵子阻遏蛋白)、tnaa(色氨酸酶)、fole(对突变gtp环化水解酶1(t198i)进行编码)、trp(色氨酸)、trm(色胺)、5-htp(5-羟色氨酸)、5-ht(血清素)、tph(色氨酸羟化酶)、tdc(色氨酸脱羧酶)、t5h(色胺5-羟化酶)、血清素乙酰转移酶(aanat)和乙酰血清素o-甲基转移酶(asmt)。
38.图2[a]:直方图,其示出了在源自六种大肠杆菌尼氏菌株(e.coli nissle strain)的细胞的培养物的培养基中测量的trm(色胺)、5-htp(5-羟色氨酸)、5-ht(血清素)的滴度,所述六种大肠杆菌尼氏菌株被工程化为分别共表达:对人tph1和水稻tdc(h1r)进行编码的tph和tdc基因;对人thp2(h2)和水稻tdc(h2r)进行编码的tph和tdc基因;对人thp2(h2)和长春花(cataranthus roseus)tdc(h2c)进行编码的tph和tdc基因;对人thp2(h2)和荷兰猪tdc(h2g)进行编码的tph和tdc基因;对小鼠tph1(m1)和水稻tdc(m1r)进行编码的tph和tdc基因;以及对小鼠thp2(m2)和水稻tdc(m2r)进行编码的tph和tdc基因。[b]:直方图,其示出了在源自三种大肠杆菌尼氏菌株的细胞的5-htp进料的培养物的培养基中测量的trm(色胺)、5-htp(5-羟色氨酸)、5-ht(血清素)的滴度,所述三种大肠杆菌尼氏菌株被工程化为分别共表达:对人thp2(h2)和水稻tdc(h2r)进行编码的tph和tdc基因;对人thp2(h2)和长春花tdc(h2c)进行编码的tph和tdc基因;对人thp2(h2)和荷兰猪tdc(h2g)进行编码的tph和tdc基因。
[0039]
图3直方图,其示出了在补充有基质的生长培养基中对共表达tph和tdc的大肠杆菌尼氏菌株(ecnδ2+puc-h2r)进行培养之后,在培养基中测量的trm(色胺)、5-htp(5-羟色
氨酸)、和5-ht(血清素)的滴度,所述滴度在10-100mg色氨酸/l的范围内。
[0040]
图4[a]曲线图,其示出了四种大肠杆菌尼氏菌株的培养物的以od
600nm
为单位测量的细胞密度。所述菌株为:ecnδ2+puc-h2r;ecnδ3+puc-h2r;ecnδ2+pmut-h2r,各自共表达人tph2(h2)和水稻tdc(r);以及ecn+pmut空质粒。ecnδ2具有缺失:δtrpr、δtnaa;ecnδ3具有缺失δtrpr、δtnaa、δinfa。[b]曲线图,其示出了与水稻tdc(r)共表达人tph2(h2)或小鼠tph1(m1)的九种大肠杆菌尼氏菌株的培养物以及包括空质粒的对照菌株的以od
600nm
为单位测量的细胞密度。[c]曲线图,其示出了在包括基于puc或基于pmut的血清素产生质粒的大肠杆菌尼氏菌株的培养物中检测到的在未进行抗生素选择的情况下在100次生长传代的时间段内测量的卡那霉素(kanamycin)抗性菌落的百分比。在每个时间点处,将细胞接种在lb琼脂板+/-卡那霉素上,并计算菌落比率(n=6)。[d]直方图,其示出了在对共表达克隆在puc(puc-h2r)或pmut(pmut-h2r)质粒中的人tph2(h2)和水稻tdc(r)的大肠杆菌尼氏菌株进行培养持续0-100次细胞传代之后,在培养基中测量的5-ht(血清素)的滴度。
[0041]
图5[a]直方图,其示出了在对puc或pmuc质粒中共表达人tph2和水稻tdc(h2r)或小鼠tph1和水稻tdc(m1r)操纵子或携带空pmut质粒的大肠杆菌尼氏菌株n、nδ2和“on”进行培养之后,在培养基中测量的trm(色胺)和5-ht(血清素)的滴度。[b]直方图,其示出了在对表达小鼠tph1(on10=on+pmutm1)、水稻tdc(on11=on+pmutr)、小鼠tph1和水稻tdc(on14=on+pmutm1r)或携带空质粒(on9=pmut)的大肠杆菌尼氏“on”菌株进行培养之后,在培养基中测量的trm(色胺)、5-htp(5-羟色氨酸)和5-ht(血清素)的滴度。示出的所有数据均为平均值,其中误差条为n=3个生物重复的标准偏差。[c]和[d]左图:直方图,其示出了在对包括与具有一系列翻译强度的rbs序列功能连接的质粒pmut-h2r和pmut-m1r的大肠杆菌尼氏菌株进行培养之后,在培养基中测量的trp(色氨酸)、trm(色胺)、5-htp(5-羟色氨酸)、以及5-ht(血清素)的滴度。右图:2维图,其示出了针对包括与具有一系列翻译强度的rbs序列功能连接的质粒pmut-h2r的大肠杆菌尼氏菌株测量的培养基中的5-ht的产率;5-htp和色胺产率,x轴线对应于tph基因的rbs强度;y轴线对应于tdc的rbs强度;划线框表示未测试的组合。[e]草图,其示出对大肠杆菌尼氏基因组的基因修饰和在[b]中测试的质粒的遗传结构的。[f]直方图,其示出在对各自包括人tph2 pmut质粒的大肠杆菌尼氏菌株nδ2(=fole wt)或on(=fole(t1981i)进行培养之后,在培养基中测量的5-htp的滴度。
[0042]
图6[a]直方图,其示出在对各自共表达与克隆在puc质粒中的不同翻译强度的rbs序列功能连接的人tph2和水稻tdc(h2r)基因的大肠杆菌尼氏菌株nδ2或菌株on进行培养之后,在培养基中测量的5-ht(血清素)和trm(色胺)滴度。[b]直方图,其示出在对各自表达与克隆在pmut质粒中的不同翻译强度的rbs序列功能连接的人tph2或小鼠tph1基因与水稻tdc(h2r)基因的组合的大肠杆菌尼氏菌株nδ2或菌株on进行培养之后,在培养基中测量的5-ht(血清素)和trm(色胺)的滴度。[c]曲线图,其示出以占总肠道微生物组群体的百分比测量的小鼠肠道中的5-ht的理论浓度相对于5-ht产生细菌的丰度。5-ht在肠道中的理论生理水平如所指示的在5-30mg/l的范围内。产生治疗有效范围的5-ht所需的5-ht产生细菌的相对丰度是针对体内5-ht产生速率(p)为0.1到10mg/l*od
630
*小时的细菌绘图的。
[0043]
图7[a]从最后一次口服管饲大肠杆菌菌株on9、on11、on14和对照(pbs)之后24小时的小鼠得到的中间结肠的薄切片的图像,其中切片用dapi和抗gfp抗体进行染色。[b]曲线图,其示出从最后一次口服管饲大肠杆菌菌株on9、on11或on14或者对照(pbs)之后24小
时的小鼠得到的十二指肠、空肠-回肠结、盲肠、近侧结肠、远侧结肠和粪便物的卡那霉素抗性、gfp阳性细菌浓度。铺板在lb琼脂板上的加上卡那霉素的样品和计数的菌落以每克粪便物的菌落形成单位(cfu)测量(n=6)。y=0处示出的数据点低于103cfu/克的检测水平。
[0044]
图8直方图,其示出血清中以mg/l测量的[a]色氨酸和[b]5-ht浓度、清洁的均质化结肠组织中的mg/g生物质、从最后一次口服管饲大肠杆菌菌株on9、on11或on14或者对照(pbs)之后24小时的小鼠得到的粪便物的mg/g生物质(n=7-8)。示出的所有p值均来自利用针对多重比较测试进行的tukey事后校正的单向anova。未示出的所有其它比较均不显著,其中p》0.05。数据是平均值,其中误差条为平均值的标准误差。[c]从最后一次口服管饲大肠杆菌菌株on9、on11、on14和对照(pbs)之后24小时的小鼠得到的中间结肠的薄切片的图像,其中切片用dapi和抗血清素抗体进行染色,其中比例尺为100μm。
[0045]
图9[a]直方图,其示出以相对mrna的形式通过δδcτ(n=6)测量的从最后一次口服管饲大肠杆菌菌株on9、on11或on14或对照(pbs)之后24小时的小鼠得到的结肠组织中的muc2、tph1、tph2和sert基因表达水平的相对表达。数据是平均值,其中误差条为平均值的标准误差。[b]从最后一次口服管饲大肠杆菌菌株on9、on11、on14和对照(pbs)之后24小时的小鼠得到的中间结肠的薄切片的图像,其中切片用dapi和抗muc-2抗体进行染色,其中比例尺为400μm。箭头表示on14中的muc2信号增加。
[0046]
图10直方图,[(a)
–
(e)]示出了从最后一次口服管饲大肠杆菌菌株on9、on11或on14或对照(pbs)之后24小时的小鼠得到的结肠组织中,5-ht受体htr1b htr1d、htr3、htr4和htr7在结肠中通过rt-pcr(n=6)进行的相对表达。(f)示出相应治疗的小鼠队列中使用6%卡红溶液(carmine red solution)(方法)(n=7-8)从口到肛门的总胃肠传输时间的直方图。示出的所有p值均来自利用针对多重比较测试进行的tukey事后校正的单向anova。未示出的所有其它比较均不显著,其中p》0.05。数据是平均值,其中误差条为平均值的标准误差。
[0047]
图11直方图,其示出:(a)小鼠在六分钟强迫游泳测试(fst)的最后四分钟期间静止所花费的时间(n=9-10);(b)在10分钟旷场测试(oft)期间产生的粪便团粒的数量(粪便球(boli)的数量)(n=7-10);(c)小鼠在10分钟oft期间行进的平均总距离(n=7-10);(d)oft期间在内部40cm
×
40cm区域或外部10cm环两者中花费的时间(n=7-10);以及(e)来自口服管饲大肠杆菌菌株on9、on11或on14或对照(pbs)之后的每个小鼠队列的单个小鼠的代表性跟踪模式。示出的所有p值均来自利用针对多重比较测试进行的tukey事后校正的单向anova。未示出的所有其它比较均不显著,其中p》0.05。数据是平均值,其中误差条为平均值的标准误差。
[0048]
图12直方图,其示出:(a)在10分钟旷场测试(oft)期间粪便球(fecal boli)的数量(n=7-10);(b)小鼠在oft期间在内部40cm
×
40cm区域中花费的时间(n=7-10);(c)小鼠在10分钟oft期间在内部40cm
×
40cm区域中行进的平均距离(n=7-10);(d)小鼠在10分钟oft期间进入到内部40cm
×
40cm区域的次数(n=7-10);(e)小鼠在10分钟oft期间行进的平均总距离(n=7-10);(f)小鼠在六分钟强迫游泳测试(fst)的最后四分钟期间静止所花费的时间(n=9-10);如施用管饲21天之后针对每个小鼠队列测量的:pbs/ip:盐水(阴性对照);管饲:pbs/ip:氟西汀(fluoxetine,ssri阳性比较物),管饲:大肠杆菌菌株on14/ip:盐水(on14阳性比较物);并且管饲:大肠杆菌菌株on14/ip:氟西汀(阳性组合比较物)。示出的
所有p值均来自利用针对多重比较测试进行的tukey事后校正的单向anova。未示出的所有其它比较均不显著,其中p》0.05。数据是平均值,其中误差条为平均值的标准误差。
[0049]
图13直方图,其示出了(a)外围血浆样品中的5-ht浓度以及(b)色氨酸浓度,c)尿液样品中的来自口服管饲大肠杆菌菌株on10或大肠杆菌菌株(ecn-对照)之后缺乏tph表达的小鼠的5-ht浓度以及d)5-htp浓度;(n=8,通过针对血浆5-ht的双尾t测试,p《0.001)。
[0050]
图14草图,其示出用于在酿酒酵母(s.cerevisiae,psc-1到psc-3)进行血清素通路表达的质粒结构。rtdc=色氨酸脱羧酶基因(水稻);ck-tdc=色氨酸脱羧酶基因(暂定万能科里氏菌(candidatus koribacter versatilis)ellin345);tph=色氨酸5-羟化酶1(小鼠)。
[0051]
图15(a)直方图,其示出在具有或不具有来自水稻(sc-1和sc-2)或来自暂定万能科里氏菌ellin345(sc-3)的表达小鼠tph1和tdc基因的质粒的酿酒酵母培养之后的培养基中测量的5-ht(血清素)的滴度。(b)直方图,其示出在来自水稻(on14)或来自暂定万能科里氏菌ellin345(m1ck)的共表达小鼠tph1和tdc基因的大肠杆菌尼氏菌株on培养之后的培养基中测量的5-ht(血清素)和trm(色胺)的滴度。(c)曲线图,其示出四种大肠杆菌尼氏菌株的培养物的以od
600nm
为单位测量的细胞密度。on对照含有pmh空,on14含有pmut14-5ht,m1r(trc)=由trc启动子表达的小鼠tph1和水稻tdc,m1ck(trc)=由trc启动子表达的小鼠tph1和ck-tdc[seq id no:112]。
[0052]
图16草图,其示出用于在枯草芽孢杆菌(b.subtilis,pbs-m1rf)中进行血清素通路表达的质粒结构。r-tdc=色氨酸脱羧酶基因(水稻);tph=色氨酸5-羟化酶1基因(小鼠),fole=突变gtp环化水解酶i基因(gch1)。
[0053]
缩写、术语和定义:
[0054]“其源自的非重组微生物”意指不包括重组核酸分子的微生物。
[0055]“产生增加量”意指相比于没有重组核酸分子的非重组生物体。例如,将表达权利要求的重组酶的重组微生物细胞与不包括权利要求中的酶的核酸分子的微生物细胞进行比较。由于使酶在根据图1的生物合成通路中进行表达的所编码核酸的表达,具有对酶进行编码的重组核酸的细胞将产生增加量的5-羟色氨酸、5-羟色胺和色胺中的一种或多种。
[0056]
gi编号:(geninfo标识符)是标识特定序列的唯一整数,其独立于数据库来源,由ncbi分配给所有处理为entrez的序列,包含来自ddbj/embl/genbank的核苷酸序列,来自swiss-prot、pir的蛋白质序列等。
[0057]
氨基酸序列同一性:如本文所用,术语“序列同一性”表示基本上相等长度的两个氨基酸序列之间的同源性程度的定量度量。要比较的两个序列必须通过插入缺口或可替代地在蛋白质序列的端部处截断来进行比对以获得最佳可能拟合。序列同一性可以计算为((nref-ndif)100)/(nref),其中ndif是在比对时两个序列中的非相同残基的总数量,并且其中nref是序列之一中的残基的数量。序列同一性计算优选地使用blast程序,例如blastp程序(pearson w.r和d.j.lipman(1988))(www.ncbi.nlm.nih.gov/cgi-bin/blast)进行自动化。多序列比对是用序列比对方法clustalw利用如在http://www2.ebi.ac.uk/clustalw/处获得的thompson j.等人,1994描述的可默认参数执行的。
[0058]
优选地,与其比较物多肽相比,多肽中的一个或多个氨基酸残基的取代、插入、添加或缺失的数量是有限的,即不多于1个、2个、3个、4个、5个、6个、7个、8个、9个或10个取代,
不多于1个、2个、3个、4个、5个、6个、7个、8个、9个或10个插入,不多于1个、2个、3个、4个、5个、6个、7个、8个、9个或10个添加,以及不多于1个、2个、3个、4个、5个、6个、7个、8个、9个或10个缺失。优选地,所述取代是保守氨基酸取代:限于以下的成员内的交换:基团1:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸;基团2:丝氨酸、半胱氨酸、硒代半胱氨酸、苏氨酸、甲硫氨酸;基团3:脯氨酸;基团4:苯丙氨酸、酪氨酸、色氨酸;基团5:天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺。
[0059]
缺乏对功能性蛋白质进行编码的基因:缺乏能够表达功能性蛋白质的基因(例如色氨酸阻遏物或色氨酸酶)的微生物是缺乏相应基因或基因id被修饰(例如被失活)使得其不能够表达功能性蛋白质的微生物。一系列基因修饰适用于灭活基因,从而使由基因编码的功能性多肽的表达丧失,所述灭活包含:基因从微生物细胞的基因组中缺失(敲除);其同源调节序列(例如启动子)缺失;取代或添加至少一个核苷酸。当所编码多肽是酶时,遗传修饰使微生物细胞中的相应多肽的可检测到的酶活性的丧失。
[0060]
基因组:是存在于细胞或生物体中的遗传物质,所述基因组包括构建和维持所述细胞或生物体所需的所有信息;并且包含位于存在于细胞或生物体中的染色体和质粒两者中的遗传物质。
[0061]
突变gtp环化水解酶i(ec 3.5.4.16):本文缩写为突变gch1,应被理解为与非突变gch1相比使色氨酸5-羟化酶(ec 1.14.16.4)的羟基化活性增加至少2倍(例如:至少3倍、或4倍、或5倍、6倍、或7倍、或8倍、或9倍或10倍)的突变gch1,如通过5-羟色氨酸产率测量的。非突变gch1可以是衍生了突变体,由此存在于突变体中的突变使活性增加的亲本酶。
[0062]
天然基因:微生物细胞基因组中的内源性基因,与宿主微生物同源。
[0063]
rbs:核糖体结合位点,是位于mrna转录物的起始密码子上游的负责蛋白质翻译起始期间核糖体的募集的核苷酸的序列。
[0064]
核糖体结合位点(rbs)计算器:提供了一种用于预测或控制细菌中翻译起始速率(tir)的方法。当用于控制给定编码序列的翻译时,rbs计算器会生成合成dna序列,所述序列将使翻译起始速率(以及因此蛋白质表达强度)被限定。对于任何启动子序列(控制转录强度),可以将许多不同的rbs强度设计为调节由此转录物产生的蛋白质的量(salis等人,2009)。
[0065]
rbs强度标度和单位:线性标度的1到1000000的输出值,其任意单位是使用荧光蛋白丰度作为表达强度的量度实验验证的(salis等人,2009)。特定强度的所设计序列不是唯一的,即不同的核苷酸序列可以对具有相同rbs强度的rbs进行编码。此外,rbs强度始终是上下文依赖性的,因此限定强度的所设计序列仅对计算所设计序列的编码序列有效。限定rbs强度的最小核苷酸序列是编码序列的起始密码子(atg)上游的35个碱基对和下游的50个碱基对。
[0066]
转基因:已天然地或通过多种基因工程化技术中的任何技术从一个生物体转移到另一个生物体的基因或遗传物质。转移到受体的转基因可以来自同一物种的其它个体或甚至来自不相关的物种。
具体实施方式
[0067]
i:在第一方面,本发明提供了一种用作药物的组合物,所述组合物包括重组微生
物的细胞,其中所述微生物包括对选自以下的多种蛋白质之一进行编码的一种或多种转基因或重组核酸分子:
[0068]
(a)色氨酸5-羟化酶(ec 1.14.16.4);
[0069]
(b)色氨酸脱羧酶(ec 4.1.1.28);以及
[0070]
(c)色胺5-羟化酶(ec:1.14.-.-)。
[0071]
因此,所述微生物的细胞能够产生相较于细胞源自的非重组微生物的细胞,增加量的5-羟色氨酸(5-ht)、5-羟色胺(5-htp)和色胺(trm)中的一种或多种。
[0072]
在其另外的方面,所述一种或多种重组核酸分子对选自下组的蛋白质进行编码:
[0073]
(a)色氨酸5-羟化酶(ec 1.14.16.4);
[0074]
(b)色氨酸脱羧酶(ec 4.1.1.28);
[0075]
(c)色胺5-羟化酶(ec:1.14.-.-);
[0076]
(d)色氨酸5-羟化酶(ec 1.14.16.4)和色氨酸脱羧酶(ec 4.1.1.28);以及
[0077]
(e)色氨酸脱羧酶(ec 4.1.1.28)和色胺5-羟化酶(ec:1.14.-.-)。
[0078]
在其另外的方面,所述组合物用作预防和/或治疗哺乳动物的trm、5-htp或5-ht相关的以下病症:中枢神经系统(cns)病症;肠内神经系统(ens)病症;胃肠(gi)病症;激素失调、代谢疾病、非酒精性脂肪肝疾病(nafld);非酒精性脂肪性肝炎(nash)、糖尿病。
[0079]
更具体地,通过本发明的组合物治疗的cns的trm、5-htp或5-ht内稳态包含焦虑和抑郁相关的行为以及记忆、认知和精神障碍;特别是广泛性焦虑症、恐惧症、社交焦虑症、恐慌症、强迫症、创伤后应激障碍、慢性应激障碍、分离和情境焦虑、年龄相关的记忆力下降以及空间记忆形成障碍、警觉、专注、学习和认知、自闭症、偏头痛以及免疫相关的病症。通过本发明的组合物治疗的gi的trm或5-ht相关的疗法包含:运动障碍、代谢综合征、肥胖症、体重控制、炎症相关疾病、炎性肠病、肠易激综合征(ibs);乳糜泻病、憩室病和结直肠癌。
[0080]
在另一方面,本发明提供了一种用作药物的组合物,所述组合物包括重组微生物,其中所述微生物包括:对以下进行编码的一种或多种转基因或重组核酸分子两者:
[0081]
(a)色氨酸5-羟化酶(ec 1.14.16.4);以及色氨酸脱羧酶(ec 4.1.1.28);或者
[0082]
(b)色氨酸脱羧酶(ec 4.1.1.28)和色胺5-羟化酶(ec:1.14.-.-);
[0083]
以及对以下进行编码的另外的转基因或重组核酸分子:
[0084]
(c)血清素乙酰转移酶(aanat)ec 2.3.1.87和
[0085]
(d)乙酰血清素o-甲基转移酶(asmt)(ec 2.1.1.4),
[0086]
其中所述细胞能够产生褪黑素。所述细胞因此能够产生相较于细胞源自的非重组微生物的细胞,在量方面增加的褪黑素。
[0087]
在其另外的方面,本发明提供了一种用作药物的组合物,其中所述组合物包括重组微生物的细胞,所述细胞:能够产生褪黑素;适用于患有褪黑素缺乏症或褪黑素相关的病症的患者的口服递送,如下褪黑素相关的病症:昼夜节律紊乱、失眠、时差、自闭症;痴呆症、情绪障碍、剧烈疼痛、癌症和2型糖尿病。
[0088]
在其另外的方面,所述组合物用于口服施用于有需要的哺乳动物。
[0089]
在其另外的方面,所述组合物中的微生物是活的兼性厌氧肠道细菌或酵母(ianiro g等人,2014),优选地其特征在于能够存活和/定殖哺乳动物肠道的一个或多个区域的共生或益生菌菌株。例如,所述细菌是选自以下属的细菌:埃希氏杆菌属、拟杆菌属、梭
菌属、栖粪杆菌属、真杆菌属、瘤胃球菌属、消化球菌属、消化链球菌属、乳杆菌属、乳球菌属、双歧杆菌属、肠球菌属、链球菌属、片球菌属、明串珠菌属、葡萄球菌属和芽孢杆菌属。合适的细菌物种包含大肠杆菌属(例如菌株尼氏)、植物乳杆菌属(lactobacillus plantarum)、嗜酸乳杆菌属(lactobacillus acidophilus)、干酪乳杆菌属(lactobacillus casei)、罗伊氏乳杆菌属(lactobacillus reuteri)、鼠李糖乳杆菌属(lactobacillus rhamnosus)、乳酸乳球菌属(lactococcus lactis)、长双歧杆菌属(bifidobacterium longum)和青春双歧杆菌属(bifidobacterium adolescentis)。此外,所述组合物中合适的微生物可以选自li等人,2014和zou等人,2019鉴定的微生物物种,所述文献的教导通过引用并入。
[0090]
在其另外的方面,所述组合物中的微生物包括对色氨酸5-羟化酶(tph)(ec 1.14.16.4)进行编码的核酸序列,所述tph催化l-色氨酸+四氢生物蝶呤+o(2)=》5-羟基-l-色氨酸+4a-羟基四氢生物蝶呤在c5位置处通过氢基化色氨酸的转化(图1)。5-羟基-l-色氨酸产率的测定和定量分别在1.1.2和1.1.3中进行了描述。在口服施用于哺乳动物之后,所述组合物中的微生物能够使tph酶在哺乳动物肠道中进行表达,以便产生和分泌5-htp(图2a)。色氨酸羟化酶的同种型中的两种同种型tph1和tph2当在本发明的微生物中进行表达时均适合于产生5-htp;以及当与具有ec 4.1.1.28的tdc共表达时适合于产生5-ht(图2a)。然而,在一优选实施例中,由于肠道的低氧环境以及与tph2相比tph1的更高的氧结合亲和力,组合物中的微生物中的用于施用于哺乳动物胃肠道的所表达tph酶是tph1。
[0091]
所述组合物中的微生物另外或可替代地包括对色氨酸脱羧酶(tdc)(ec 4.1.1.28)进行编码的核酸分子,所述tdc催化5-羟基-l-色氨酸=》5-羟色胺+co2的转化(图1)。5-羟色胺产率的测定和定量在1.1.2和1.1.3中进行了描述。包括能够表达tph和tdc酶两者的微生物的细胞的组合物能够在哺乳动物肠道中产生和分泌5-ht(图2a)。相反,包括能够表达tdc酶的微生物的细胞的组合物能够在哺乳动物肠道中产生和分泌trm(图1、5b)。微生物的5ht生产率可以通过细胞中表达的tph和tdc酶的所选组合进行调节(实例1)。因此,在一些微生物中,所表达酶的组合是(a)色氨酸5-羟化酶,所述色氨酸5-羟化酶的氨基酸序列与seq id no:6或12具有至少80%的序列同一性,并且其中所述色氨酸脱羧酶的氨基酸序列与seq id no:18具有至少80%的序列同一性。
[0092]
在另外的方面,所述组合物中的微生物包括对色胺5-羟化酶进行编码的重组核酸分子或转基因,所述色胺5-羟化酶催化o2+还原的[nadph—血红素蛋白还原酶]+色胺=》h++h2o+氧化的[nadph—血红素蛋白还原酶]+血清素的转化(图1)。色胺产率的测定和定量在1.1.2和1.1.3中进行了描述。优选地,所述组合物中的微生物进一步包括对tdc进行编码的核酸序列。在口服施用于哺乳动物之后,所述组合物中的微生物能够使tph和t5h酶在哺乳动物肠道中进行表达,以便产生和分泌5-ht(图1)。
[0093]
在另外的方面,所述组合物中的微生物包括对tph和tdc或者tdc和t5h
[0094]
以及以下酶进行编码的核酸分子或转基因:
[0095]-血清素乙酰转移酶(aanat)ec 2.3.1.87,所述aanat催化乙酰基-coa和血清素到coa和n-乙酰基-血清素的转化;以及
[0096]-乙酰血清素o-甲基转移酶(asmt)(ec 2.1.1.4),所述asmt催化由l-色氨酸产生褪黑素的最后反应,即n-乙酰基-血清素和s-腺苷基-l-甲硫氨酸(sam)到褪黑素和s-腺苷
基-l-高半胱氨酸(sah)的转化。然后sah可以通过微生物细胞中的s-腺苷基-l-甲硫氨酸循环再循环回到sam,其中所述s-腺苷基-l-甲硫氨酸循环是天然的(或外源添加的)并且组成性地进行编码,例如在大肠杆菌中(图1)。
[0097]
在另外的方面,所述微生物通过引入对所述5-ht或包含tph、tdc、t5h、aanat和asmt酶的褪黑素通路酶进行编码的异源性核酸分子进行基因修饰;其中所述异源性核酸分子各自与如组成型或诱导型启动子等启动子同源连接。对所述酶进行编码的异源性核酸分子可以克隆在与公共同源启动子连接的操纵子内。所述异源性核酸分子可以克隆到引入到微生物中的自我复制游离体中,或者可以克隆到微生物的染色体中。游离体可以是微生物的天然质粒或异源性质粒。优选地,所述质粒缺乏促进转导为另一种微生物细胞的遗传元素;或者可替代地,所述质粒包括对所述微生物细胞的存活来说必需的蛋白质进行编码的基因(即,如实例3中所述的必需基因)。
[0098]
在其另外的方面,所述微生物在缺乏能够表达功能性trp操纵子阻遏蛋白和/或功能性色氨酸酶(ec:4.1.99.1)的基因(图1)方面被进一步基因修饰。不能够表达功能性trp操纵子阻遏蛋白的微生物缺乏形成与l-色氨酸的复合物并结合trp操纵子(例如5'-actagt-'3')的操纵区域所需的阻遏蛋白,并且因此不能够预防色氨酸生物合成通路转录的启动。不能够表达功能性色氨酸酶(ec 4.1.99.1)的微生物不能够催化以下的反应:l-色氨酸+h(2)o《=》吲哚+丙酮酸+nh(3)。由于到色氨酸通路中的增强的通量,缺乏能够表达功能性trp操纵子阻遏蛋白以及功能性色氨酸酶(ec 4.1.99.1)的基因的本发明的微生物产生增强水平的5-ht和trm(实例2、4和图3、6a)。
[0099]
在其另外的方面,所述微生物被进一步遗传修饰,以包括对突变gtp环化水解酶i ec 3.5.4.16(gchi)进行编码的基因,其中与天然非突变gch1(例如亲本gch1)相比,所述突变体使所述tph的羟基化活性增加至少2倍、或3倍、或4倍、或5倍、6倍、或7倍、或8倍、或9倍或10倍,如通过5htp产率测量的。gch1催化tph合成所需的由gtp进行的四氢生物蝶呤辅因子的再生(图1)。表达突变gch1酶的缺乏trpr和tnaa基因两者的本发明的微生物由于朝5htp合成的增强的通量产生了增加量的5-ht和trm(实例4,图5a、6a)。
[0100]
在其另外的方面,所述微生物包括对(a)色氨酸5-羟化酶(ec 1.14.16.4)和(b)色氨酸脱羧酶(ec:4.1.1.28)进行编码的重组核酸序列,并且被进一步遗传修饰以调节5-ht通路的tph和tdc酶的相对表达水平,以便于进一步增加所产生的5-ht的量,同时减少trm的产生。例如,tph和tdc的表达通过与其相应的核酸编码序列(即基因)中的每个编码序列功能连接的rbs独立地进行调节。当tph基因的rbs的强度超过tdc基因的rbs(以翻译起始的相对强度测量)时,5-ht产率增加而trm水平降低,如实例4所示(图5c、d;图6a)。缺乏trpr和tnaa基因的本发明的微生物的5-ht生产率在tph基因转录物的翻译速率超过tdc基因转录物的转录速率时,借助于其相应功能连接的rbs协同地增加(图6a、b)。
[0101]
根据本发明的组合物用作动物,特别是选自由以下组成的组的哺乳动物的药物:人、狗、猫、猪、牛、马、山羊和绵羊以及家禽(例如鸡)。在一个实施例中,所述组合物用作孕妇或哺乳期妇女的药物。
[0102]
在治疗应用中,如治疗哺乳动物的trm、5-htp或5-ht相关的以下病症:中枢神经系统(cns)病症;肠内神经系统(ens)病症;胃肠(gi)病症和代谢病症或褪黑素相关的病症,根据本发明的组合物用于以足以至少部分地治愈疾病和其并发症或遏制其症状的量施用。足
以实现这一点的量被定义为“治疗有效剂量”。出于此目的有效的量将取决于本领域的技术人员已知的许多因素,如疾病的严重程度以及患者的体重和一般状况。
[0103]
在预防性应用中,类似地,根据本发明的组合物用于以足以至少部分地降低发生疾病的风险的量施用于对特定疾病易感或有患特定疾病的风险的受试者。此量被定义为“预防有效剂量”。同样,精确的量取决于许多患者特定的因素,如患者的健康状况和体重。
[0104]
本发明的微生物可以以纯形式提供或可以掺入在基质中。这种基质可以在通过胃肠道期间有利地保护微生物(包含胃部的酸性条件)并且使得微生物的活细胞能够到达肠道。这种保护性基质可以包括糖(如麦芽糖糊精)、蛋白质或脂肪组分。在一个实施例中,保护性基质包括植物油或者是植物油。微生物可以根据任何合适的方法培养并且制备以用于通过例如冷冻干燥或喷雾干燥而包封或添加到营养组合物中。可替代地,可以购买已经以合适的形式制备以添加到食品产物中的微生物。
[0105]
合适的营养组合物包含乳产品、饮料粉末、脱水汤、膳食补充剂、膳食替代品、营养棒、谷物、糖果产品、动物饲料补充剂或干宠物食品。
[0106]
本发明的组合物可以进一步含有保护性水状胶体(如树胶、蛋白质、改性淀粉)、粘合剂、成膜剂、包封剂/材料、壁/壳材料、基质化合物、涂料、乳化剂、表面活性剂、增溶剂(油、脂肪、蜡、卵磷脂等)、吸附剂、载体、填充剂、复合化合物、分散剂、润湿剂、加工助剂(溶剂)、流动剂、掩味剂、增重剂、胶凝剂、凝胶形成剂、抗氧化剂和抗微生物剂。所述组合物还可以含有常规药物添加剂和佐剂、赋形剂和稀释剂,包含但不限于水、任何来源的明胶、植物树胶、木质素磺酸盐、滑石、糖、淀粉、阿拉伯树胶、植物油、聚烷撑乙二醇、调味剂、防腐剂、稳定剂、乳化剂、缓冲剂、润滑剂、着色剂、润湿剂、填充剂等。在所有情况下,将选择考虑到对于预期受体的适用性的此类另外的组分。
[0107]
在本发明的一优选方面,所述组合物进一步含有至少一种益生元。因此,益生元可以促进本发明的微生物在口服施用之后的受试者的肠中的定殖,并且由此可以增强根据本发明的组合物中含有的微生物的作用。此外,几种益生元对例如消化具有积极影响。
[0108]
优选地,益生元可以选自由寡聚糖组成的组并且任选地含有果糖、半乳糖、甘露糖、大豆和/或菊粉、膳食纤维或其混合物。本发明的组合物可以以粉末形式提供,其水活度小于0.2,例如在0.19-0.05的范围内,优选地小于0.15。
[0109]
口服施用之后,本发明的微生物能够存活和/或定殖于肠道的一个或多个区域,包含十二指肠、小肠、盲肠、近侧结肠和远侧结肠。如实例6中所例示的,口服施用的微生物主要定殖于盲肠、近侧结肠和远侧结肠。
[0110]
在肠道定殖之后,本发明的微生物显示出产生可在其粪便中检测到的5-ht,并且重要的是伴随着肠道的粘膜层中5-ht的水平增加(实例6)。此外,看到定殖微生物诱导在基因表达和肠道生理两者中的治疗有益的变化。具体地,观察到的肠道生理的变化包含粘膜层增加、肠道屏障功能的标志物水平得以维持以及肠道炎症的标志物水平降低,其中每一种都与对5-ht相关的gi病症的治疗作用相称。也观察到5-ht相关的受体htr1b和htr1d在肠道中的表达,在施用本发明的微生物之后,产生升高水平的5-ht或trm与对5-ht相关的cns病症,包含偏头痛的治疗作用相称(实例8)。
[0111]
根据本文执行的临床前试验,使用以下良好确立的方法证明了根据本发明的组合物对受试者的施用对cns相关的病症具有预防和治疗作用:强迫游泳测试(fst)和旷场测试
(oft)(实例9和10)。
[0112]
ii.在第二方面,本发明提供了一种重组细菌,所述重组细菌包括对选自以下的多种蛋白质之一进行编码的一种或多种重组核酸分子或转基因:
[0113]
(a)色氨酸5-羟化酶(ec 1.14.16.4);
[0114]
(b)色氨酸脱羧酶(ec 4.1.1.28);以及
[0115]
(c)色胺5-羟化酶(ec:1.14.-.-),
[0116]
其中所述微生物缺乏能够表达
[0117]
trp操纵子阻遏蛋白和色氨酸酶(ec:4.1.99.1)的基因,并且
[0118]
其中所述细胞能够产生相较于细胞源自的非重组微生物的细胞,增加量的5-羟色氨酸、5-羟色胺和色胺中的一种或多种。
[0119]
在其另外的方面,所述一种或多种重组核酸分子或转基因对选自下组的蛋白质进行编码:
[0120]
(a)色氨酸5-羟化酶(ec 1.14.16.4);
[0121]
(b)色氨酸脱羧酶(ec 4.1.1.28);
[0122]
(c)色胺5-羟化酶(ec:1.14.-.-);
[0123]
(d)色氨酸5-羟化酶(ec 1.14.16.4)和色氨酸脱羧酶(ec 4.1.1.28);以及
[0124]
(e)色氨酸脱羧酶(ec 4.1.1.28)和色胺5-羟化酶(ec:1.14.-.-)。
[0125]
在另外的方面,所述细菌包括对以下进行编码的重组核酸分子:
[0126]
(a)色氨酸5-羟化酶(ec 1.14.16.4)和色氨酸脱羧酶(ec 4.1.1.28);或
[0127]
(b)色氨酸脱羧酶(ec 4.1.1.28)和色胺5-羟化酶(ec:1.14.-.-);以及
[0128]
另外对以下进行编码的重组核酸分子:
[0129]
(c)血清素乙酰转移酶(aanat)ec 2.3.1.87;以及
[0130]
(d)乙酰血清素o-甲基转移酶(asmt)(ec 2.1.1.4),
[0131]
其中所述细胞能够产生相较于细胞源自的非重组细菌的细胞量增加的褪黑素。
[0132]
在其另外的方面,所述细菌进一步包括对突变gtp环化水解酶i(gchi)进行编码的基因,所述gchi的氨基酸序列与具有seq id no:2的野生型gchi具有至少70%、71%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性并且包括一个或多个突变,其中与天然gch1相比,所述突变体使所述tph的羟基化活性增加。
[0133]
例如,突变gtp环化水解酶i(gch1)是氨基酸残基中的选自由以下组成的组的至少一个或多个突变:d97、m99、t101、v102、a125、k129、n170、v179、t196、t198、s199、l200、s207、h212、e213、f214、l215和h221,其中n170中的突变为n170k、n170d或n170l;v179中的突变为v179a;h212中的突变为h212r或h212k;并且h221中的突变为h221r或h221k。优选地,所述突变是选自以下的取代:t198i、t198s、f214s、v179a、m99i和l200p。
[0134]
技术人员将能够通过突变gch1和色氨酸5-羟化酶在微生物细胞中的共表达并且对色氨酸羟基化为5-羟色氨酸的活性增加进行测试来对另外的突变体进行测试。优选地,相较于突变体源自的非突变gch1,突变gch1使色氨酸5-羟化酶的羟基化活性增加至少2倍、或3倍、或4倍、或5倍、6倍、或7倍、或8倍、或9倍、或10倍,如通过5-羟色氨酸产率测量的。
[0135]
在其另外的方面,所述细菌能够表达具有色氨酸5-羟化酶(ec 1.14.16.4)活性的
蛋白质,其中所述蛋白质的氨基酸序列与seq id no:6、8或12具有至少70%、71%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0136]
在其另外的方面,所述细菌能够表达具有色氨酸脱羧酶(ec 4.1.1.28)活性的蛋白质,其中所述蛋白质的氨基酸序列与seq id no:14或18具有至少70%、71%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0137]
在其另外的方面,所述细菌能够表达具有色胺5-羟化酶(ec:1.14.-.-)活性的蛋白质,其中所述蛋白质的氨基酸序列与seq id no:20具有至少70%、71%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0138]
在其另外的方面,所述细菌能够表达具有血清素乙酰转移酶ec 2.3.1.87活性的蛋白质,其中所述蛋白质的氨基酸序列与seq id no:22具有至少70%、71%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0139]
在其另外的方面,所述细菌能够表达具有乙酰血清素o-甲基转移酶(ec 2.1.1.4)活性的蛋白质,其中所述蛋白质的氨基酸序列与seq id no:24具有至少70%、71%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0140]
在其另外的方面,包括对(a)色氨酸5-羟化酶(ec 1.14.16.4)和(b)色氨酸脱羧酶(ec 4.1.1.28)进行编码的重组核酸分子的所述细菌,其中所述色氨酸5-羟化酶与seq id no:6或12具有至少80%的序列同一性,并且其中所述色氨酸脱羧酶的氨基酸序列与seq id no:18具有至少80%的序列同一性。
[0141]
在其另外的方面,包括对(a)色氨酸5-羟化酶(ec 1.14.16.4)和(b)色氨酸脱羧酶(ec 4.1.1.28)进行编码的重组核酸分子的所述细菌被进一步遗传修饰以上调5-ht通路中tph相对于tdc酶的表达水平,以便于进一步增加产生的5-ht的量并减少trm产生。例如,对色氨酸5-羟化酶和色氨酸脱羧酶进行编码的核酸分子各自与其相应的rbs功能连接,其中其强度比率为至少:1.5:1.0;1.75:1.0;2.0:1.0;2.5:1.0;3.0:1.0;3.5:1.0;4.0:1.0;4.5:1.0;5.0:1.0;5.5:1.0;6.0:1.0;6.5:1.0;7.0:1.0;7.5:1.0;8.0:1.0;8.5:1.0;9.0:1.0;9.5:1.0;10.0:1.0;20:1;40:1;60:1.0;80:1.0;100:1.0;150:1.0;200:1.0;250:1.0;以及300:1.0,更优选地为至少20.0:1.0;其中rbs强度如以上所定义的进行测量,其中参考了salis等人,2009。
[0142]
可替代地,包括对(a)色氨酸5-羟化酶(ec 1.14.16.4)和(b)色氨酸脱羧酶(ec 4.1.1.28)进行编码的重组核酸分子的所述细菌被进一步遗传修饰以上调5-ht通路中tdc相对于tph酶的表达水平,以便于进一步增加trm产生的量。出于此目的,对色氨酸脱羧酶和色氨酸5-羟化酶进行编码的核酸分子各自与其相应的rbs功能连接,其中其强度比率为至少:1.5:1.0;1.75:1.0;2.0:1.0;2.5:1.0;3.0:1.0;3.5:1.0;4.0:1.0;4.5:1.0;5.0:1.0;5.5:1.0;6.0:1.0;6.5:1.0;7.0:1.0;7.5:1.0;8.0:1.0;8.5:1.0;9.0:1.0;9.5:1.0;10.0:1.0;20:1;40:1;60:1.0;80:1.0;100:1.0;150:1.0;200:1.0;250:1.0;以及300:1.0,更优
选地为至少2.0:1.0。
[0143]
在其另外的方面,本发明的细菌中的对(a)色氨酸5-羟化酶(ec 1.14.16.4)和/或(b)色氨酸脱羧酶(ec 4.1.1.28)进行编码的一种或多种重组核酸分子与组成性地调节表达或可诱导的启动子功能连接。当启动子是组成型启动子时,合适的启动子可以选自以下描述的合成启动子:http://parts.igem.org/promoters/catalog/anderson,优选地选择在安德森量表(anderson scale)上所测量强度≥0.5的强启动子。
[0144]
在其另外的方面,所述细菌不能表达功能性trp操纵子阻遏蛋白,其中所述蛋白质的氨基酸序列与seq id no:26具有至少70%、71%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0145]
在其另外的方面,所述细菌不能够表达具有色氨酸酶活性(ec:4.1.99.1)的蛋白质,其中所述蛋白质的氨基酸序列与seq id no:29具有至少70%、71%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。
[0146]
在其另外的方面,所述细菌对一种或多种临床上使用的抗生素剂是无抗生素抗性的。
[0147]
根据第二方面的呈其各种描述的形式的重组细菌适用于根据本发明的另外的方面中的每个方面的组合物。
[0148]
实例
[0149]
实例1:经遗传修饰的大肠杆菌细胞表达用于5-ht产生的生物合成通路
[0150]
将5-ht生物合成通路引入到大肠杆菌尼氏的细胞中以建立合成血清素通路以催化trp转化为5-htp并且然后5-htp转化为5-ht的两个连续代谢步骤(图1)。通过表达和确定可从tph和tdc基因的组合中获得的5-ht产率来确定对用于催化这两个代谢步骤的最佳组合酶的鉴定。
[0151]
1.1方法
[0152]
1.1.1经修饰的大肠杆菌细胞如下工程化,参照表1:
[0153]
从德国ardeypharm有限公司(ardeypharm gmbh,germany)购买了宿主菌株大肠杆菌尼氏1917将绿色荧光蛋白的基因(gfp,genbank:cah64882.1)置于强组成型启动子(组件bba_j23101,标准生物学组件登记库(registry of standard biological parts),www.parts.igem.org)的控制下并且在tn7连接位点处使用如mckenzie等人(2006)所述的pgrg25整合到大肠杆菌尼氏基因组中。对源自哺乳动物或植物来源的tph蛋白:人tph1(h1);人thp2(h2);小鼠tph1(m1);小鼠thp2(m2)进行编码的基因以及对源自水稻tdc(r)、长春花(c)、荷兰猪(g)和暂定万能科里氏菌ellin345(ck)的tdc进行编码的基因采用了使用来自idt的在线工具(idtdna.com/codonopt)针对大肠杆菌优化的密码子来合成。在合成启动子bba-j23107的控制下,将所测试tph和tdc基因组合以操纵子的形式克隆在包括卡那霉素抗性基因的自我复制质粒(使用puc作为骨架)中。随后通过采用本领域已知的标准克隆和转换程序将质粒转换到宿主菌株中。
[0154]
1.1.2生长和体外代谢产物产生确定如下:
[0155]
使菌株在改性m9培养基中生长,所述培养基含有1
×
m9盐(m6030,西格玛奥德里奇
公司(sigma aldrich))、0.2%(w/v)葡萄糖、0.1%(w/v)酪蛋白氨基酸(目录号:c2000,teknova公司)、1mm mgso4、50μm fecl3、0.2%(v/v)2yt培养基(成分见以下)和50mg/l的l-色氨酸,除非另有说明。以50mg/l的最终浓度添加卡那霉素,除非另有说明。从每个菌株中挑取三个单独菌落,使其在96深孔板中在300μl培养基中生长,并且在37℃下以250rpm振荡持续16小时。通过将这种预培养物1:100稀释到新鲜培养基中来接种主要培养物,并且使细胞在相同条件下生长24小时。在基质进料的情况下,将trp和5-htp以100mg trp或5-htp/l的量添加到生长培养基中。之后,使用0.2μm孔径过滤器将培养物上清液与细胞分离,并且在通过lc-ms进行分析之前冷冻在-20℃下。显示的所有数据为来自至少3个生物重复的平均值+/-sd。
[0156]
1.1.3通过lc-ms对代谢物产生进行定量如下:
[0157]
在连接到orbitrap fusion质谱仪(加利福尼亚州圣何塞的赛默飞世尔科技公司(fisher scientific,san jose,ca))的dionex ultimate 3000uhplc(加利福尼亚州圣何塞的飞世尔科技公司)上通过液相色谱质谱(lc-ms)测量执行对血清素、色胺、色氨酸和5-htp的检测。所述系统使用保持在35℃下的agilent zorbax eclipse plus c18 2.1
×
100mm、1.8μm柱。流速为0.350毫升/分钟,其中0.1%甲酸(a)和含0.1%甲酸的乙腈(b)为流动相。梯度以5%b开始,并且之后是在1.5分钟内到35%b的线性梯度。将此溶剂组合物保持3.5分钟,然后立即将其改为95%b并且保持1分钟。最后,6分钟之后将梯度改为5%b。以正离子模式将样品(1ul)传递到配备有加热式电喷雾电离源(hesi)的ms中,其中鞘气设置为60(任意单位),辅助气设置为20(任意单位),吹扫气设置为2(任意单位)。锥体和探针温度分别为380℃和380℃,并且喷雾电压为3500v。扫描范围为50da到500da,并且扫描之间的时间为100毫秒。在全扫描中执行血清素(160.07646离子)、色胺(144.08158和161.10775离子)和色氨酸(205.09785离子)的检测,而在hcd碎裂之后执行5-htp检测(221.09》162.05553,25%hcd ce)。化合物的定量是基于由在24个样品组之前和之后分析的校准标准物进行的计算进行的。所用试剂均为分析等级。
[0158]
1.2结果:
[0159]
发现被工程化为表达小鼠tph1(m1)或人tph2(h2)的宿主大肠杆菌尼氏与来自小鼠(r)或长春花(c)的tdc组合的经基因修饰的菌株可产生可测量量的血清素产生(图2a)。当在培养期间对菌株用基质5-htp进料时,表达对水稻tdc(r)进行编码的基因的细胞产生最高产率的5-ht(79.5
±
11.1%产率),这表明水稻tdc在催化5-htp脱羧步骤方面是最高效的(图2b)。因此,选择了表达“m1r”和“h2r”通路的为5-ht产生剂的大肠杆菌尼氏以供进一步优化。
[0160]
进料到tdc显示出所有酶都会产生一些血清素,但来自水稻的“r”酶的转化率最高(右图)。
[0161]
实例2:通过增加色氨酸通路通量来增强本发明的经遗传修饰的大肠杆菌细胞的5-ht和trm产生
[0162]
色氨酸通路基质色氨酸的可用性增加显示出增加了本发明的5-ht产生菌株中的5-ht产生(图3)。根据此观察增加,在本发明的经基因工程化的细胞中可用trp的内源性池增加,是通过灭活对色氨酸阻遏trpr和色氨酸酶tnaa进行编码的内源性基因产生的,如增强色氨酸通路通量。
[0163]
2.1方法:
[0164]
使用如(mehrer等人,2018)中所述的crispr/cas9执行了从宿主大肠杆菌尼氏基因组中敲除trpr和tnaa。简而言之,使用了由诱导型cas9/λ-red表达质粒和引导rna(grna)质粒组成的双质粒系统以在宿主基因组中的所期望的基因基因座处引入双链断裂。在上传ecn基因组序列(genbank:cp007799.1)之后使用crispy-web(blin等人,2016)对grna进行了设计。用于在选定切割位点处进行同源重组的模板如下生成:在可用的情况下,将来自keio文库(baba等人,2006)的具有期望的敲除的菌株(分别为δtrpr::frt-kan-frt或δtnaa::frt-kan-frt)用psij8(jensen等人,2015)进行转换,并且诱导flp重组酶基因以去除卡那霉素抗性基因。针对卡那霉素敏感性对所得菌落进行筛选。δtrpr::frt或δtnaa::frt基因组使用结合frt位点上游和下游的500bp的寡核苷酸进行扩增以产生大约1kb的pcr产物。如前所述(mehrer等人,2018),从菌株中治愈了crispr/cas9和grna表达质粒。
[0165]
如实例1.1.2和1.1.3中所述执行宿主细胞的生长;其代谢物产生和定量。
[0166]
2.2结果:
[0167]
为了朝5-ht通路导引内源性色氨酸的对应通量,通过从宿主基因组中敲除对trpr和tnaa进行编码的基因来对本发明的菌株进行进一步工程化为产生命名为nδ2的宿主大肠杆菌尼氏菌株。外源性色氨酸供应显示出通过本发明的此类经遗传修饰的大肠杆菌尼氏细胞(图3中的菌株ecnδ2+puc-h2r)进一步增强了5ht和trm产生。
[0168]
实例3:本发明的经遗传修饰的大肠杆菌菌株表现出稳定的5-ht产生
[0169]
当将对5-ht生物合成通路进行编码的5-ht操纵子克隆到本发明的宿主细胞中的多拷贝质粒中时,5-ht的产生取决于质粒的稳定性。稳定性优选地不取决于赋予抗生素抗性的质粒基因。将用于赋予质粒稳定性的两种溶液进行比较;基于puc的质粒骨架(如实例1和2中的)和大肠杆菌尼氏pmut1的两种天然质粒(blum-oehler等人,2003)。
[0170]
3.1方法:
[0171]
通过在h2r通路操纵子下游引入必需细菌基因infa的合成拷贝来对高拷贝数5-ht产生质粒(puc-h2r)进行修饰。使用实例2.1中所述的方案敲除宿主基因组中的对应infa基因,以便产生大肠杆菌尼氏菌株nδ3(δtrpr、δtnaa、δinfa)。
[0172]
包括h2r通路的操纵子也被克隆到质粒pmut1(genbank:a84793.1)中,如下。将pmut1质粒与野生型大肠杆菌尼氏分离,并且扩增以作为pmut骨架。去除可以实现质粒转移的元素以产生pmut(来自环状序列a84793.1的δbp 1
–
1323和1664
–
3117),并且将卡那霉素抗性基因和h2r或m1r操纵子(不具有infa)插入到骨架中以分别产生pmut-h2r或pmut-m1r。
[0173]
产生了以下额外版本的质粒pmut-h2r或pmut-m1r:将hok/sok毒素-抗毒素质粒稳定性元素(genbank:mk134376,区域58002-58601)插入到pmut-m1r骨架中以产生质粒pmut14-ser。从pmut14-ser中去除tph基因以产生pmut11-trm,并且去除tph和tdc两者以产生制成pmut09-ctrl。
[0174]
细胞生长确定:使细胞如实例1.1.2中所述生长,但其中在接种主要培养物之后,将200μl转移到平底透明的96孔微量滴定板中;然后用气体可渗透膜(z380059,西格玛奥德里奇公司)密封。使培养物在37℃下在700rpm轨道振荡的情况下生长,并且每10分钟在biotektmelx800读板仪上在od
630nm
处记录其的生长情况。
[0175]
质粒稳定性确定:从每个所测试菌株中各自挑取六个单独菌落,使其在96深孔板
pmutr)的组合的on菌株分别产生了5-htp和trm作为所述通路的唯一检测到的产物(图5b)。
[0188]
使用针对其相应的基因的核糖体结合位点(rbs)的选定组合调节tph和tdc的相对表达强度显示出可增强5-ht产生并减少trm的积累(图5c和d)。当与tph基因功能连接的rbs的相对强度超过与tdc基因功能连接的rbs的相对强度时,5-ht生产增加。
[0189]
图6展示了引入到包括5-ht通路的基因的大肠杆菌尼氏菌株的遗传修饰对其相应的5-ht生产率和5-ht:trm比率的协同作用。trpr和tnaa基因在大肠杆菌基因组中的敲除赋予了在大肠杆菌细胞中通过功能连接的rbs对5-ht产率和5-ht:trm比率的协同作用,条件是tph基因的相对表达超过了tdc基因的相对表达(图6a)。当与大肠杆菌尼氏菌株前述突变组合时,所述fole基因组突变(对t198i取代进行编码)的引入进一步增加了5-ht产率和5-ht:trm比率(图6b)。
[0190]
实例5:预测本发明的经遗传修饰的大肠杆菌菌株的口服施用在受试者体内产生治疗性5-ht水平
[0191]
据报道,肠道中的治疗有效水平的5-ht在5-30mg/l的范围内(liu,q.等人,2008)。预测在小鼠肠道中产生治疗有效范围的5-ht所需的5-ht产生细菌的相对丰度对于细菌而言其体内5-ht产生速率为0.1到10mg/l*od
630
*小时(图6c)。这是基于相对于肠道中细菌的密度进行的基本假设,预测范围为1e2-e11/g(sender等人,2016),这取决于位置(casteleyn等人,2010),如下所示。
[0192][0193]
*大肠杆菌:1od600nm(在标准1cm缺口长度分光光度计中)=0.36g/l=8*e8个细胞/ml
[0194]
体外特异性生产率(p)可以以血清素滴度(以mg/l计)每细菌负荷(以od
630nm
计)每小时测量。由于5-ht消耗率是未知的,因此将其设置为等于生产率以确定生理相关浓度(以mg/l计)。预测本发明的经遗传修饰的大肠杆菌菌株(例如菌株on14)在施用时能够在体内产生接近生理相关水平的5-ht。
[0195]
实例6:本发明的经遗传修饰的大肠杆菌菌株的口服施用增强小鼠肠道内的5-ht水平
[0196]
小鼠体内展示了本发明的经遗传修饰的大肠杆菌尼氏菌株的口服递送以及其到肠道的定位和5-ht产生的增强。
[0197]
6.1方法
[0198]
6.1.1口服施用:在恒定温度下在无特定病原体(spf)设施中随意获取食物和水的情况下将由塔康生物科学(taconic biosciences)或杰克逊实验室(jackson laboratories)提供的6-8周龄的雄性小鼠(c57bl/6)分组圈养在12小时明:暗循环(7:00-19:00亮灯)。在递送时,每周给予小鼠以调节新位置,然后进行7天3次旋转的微生物组归一
化方案。在归一化方案的第一天、第三天和第五天,将小鼠随机混合。在第6天,将小鼠最后一次混合并分在其相应的队列中,其中每个队列2-3个笼子,每个笼子中3-5只小鼠,具体数量取决于实验。在第七天,小鼠开始第零天实验方案,被标记以进行标识并且以3-5只小鼠为一组圈养在瓶进料笼子中,设置在指定的架上,并且仅在层流罩下打开。在实验方案的第零天收集粪便样品。并且每24小时在每天的同一时间对小鼠进行口服管饲持续10天,其中指定了200μl的大肠杆菌尼氏菌株的无菌pbs或新鲜生长109个细胞:含on14(包括质粒pmut14-ser的大肠杆菌尼氏菌株on)、on11(包括质粒pmut11-trm的大肠杆菌尼氏菌株on)和on9(包括质粒对照质粒pmut9-ctrl的大肠杆菌尼氏菌株on)是pbs(图5e)。最后一次管饲之后24小时,收集粪便团粒,并且对小鼠执行安乐死以进行血清、肠组织和腔内粪便收集,或使用小鼠以进行运动或行为测试。
[0199]
6.1.2on菌株的肠道定位:通过将源自不同肠道区域的消化物铺板在包括50mg/l卡那霉素的lb琼脂生长培养基上并对gfp阳性、卡那霉素抗性(kanr)菌落的数量进行定量来确定。
[0200]
6.1.3薄切片的免疫检测:收集结肠样品,并且在中部结肠中切割5mm切片,并将所述切片固定在甲醇carnoy(60%甲醇、30%氯仿、10%乙酸)溶液中或含4%多聚甲醛(pfa)的磷酸盐缓冲溶液(pbs)中持续24小时。然后将固定的样品洗涤三次并储存在70%乙醇中。将样品与管腔中的消化物保持完整,包埋在石蜡中并以4μm腔内切割,并且准备好以用于免疫组织化学或进行苏木精和伊红染色。对于免疫组织化学:使用了pfa固定的载玻片以用于血清素(5-ht)抗体染色,并且使用methacarn固定的样品以用于muc2、绿色荧光蛋白(gfp)和嗜铬粒蛋白a(cga)抗体染色。将所有载玻片在57℃下烘烤2小时,以二甲苯和乙醇-水梯度进行脱蜡,再水化,然后用10mm柠檬酸钠,ph 6.0的抗原恢复溶液在90℃下处理30分钟。在室温下用含5%胎牛血清(fbs)的pbs将载玻片封闭30分钟,并且然后用第一抗体在4℃下在含5%fbs的pbs中培育过夜。用pbs将载玻片洗涤三次,与第二抗体一起在室温下在pbs中培育2小时,在pbs中洗涤三次,与dapi(4',6-二脒基-2-苯基吲哚)一起以10μg/ml培育5分钟,在pbs中洗涤三次,并且使用甘油封固。用与alexa荧光团预偶联的第一抗体染色的载玻片未进行第二抗体染色。使用的抗体:具有alexa fluor 594缀合物的抗gfp兔igg(生命技术公司(life technologies)a21312)。抗muc2多克隆兔(圣克鲁斯技术公司(santa cruz technologies)sc-15334)。抗嗜铬粒蛋白a多克隆兔(abcam公司ab15160)。抗血清素多克隆山羊(abcam公司ab66047)。二级抗兔alexa fluor 568(赛默飞世尔公司novex a11011)。二级抗山羊igg alexa fluor 488(abcam公司ab150077)。利用尼康eclipse ti2-e倒置显微镜系统提取所有图像,使用nis-elements、高级研究软件(advanced research software)和macbook版本2.0.0-rc-69/1.52i的imagej(fiji)执行图像转化和细胞大小(颗粒)分析。
[0201]
6.1.4体内代谢物分析针对血清素、5-羟色氨酸、色胺和色氨酸对血清、组织样品和粪便样品进行分析。对于血清:安乐死后通过下腔静脉收集血液样品,将样品与0.9%nacl、0.2%抗坏血酸1:1混合。将样品保持在室温下持续10分钟,然后置于冰上,之后在4℃下以2000g离心10分钟。将上清液保存以供分析并立即冷冻在-20℃下。对于组织分析:在收集结肠组织后对其称重并立即冷冻在液氮中,并且使用不锈钢微瓶(biospec 2007)用单个6.34mm不锈钢珠(biospec 11079635ss)在beadbeater(biospec 112011)中敲击30秒以使其冷冻断裂。然后将组织重悬在0.9%nacl、0.1%抗坏血酸中,在4℃下以2000g离心10分
钟。将上清液保存以供分析并立即冷冻在-20℃下。对于粪便样品:将样品称重,置于具有0.5ml的0.9%nacl、0.1%抗坏血酸与200ml氧化锆/二氧化硅珠粒(biospec 11079101z)的康宁低温瓶中,并在beadbeater中以4℃敲击5分钟。将样品在4℃下以2000g离心10分钟。将上清液保存以供分析并立即冷冻在-20℃下。
[0202]
6.2结果
[0203]
在向小鼠口服施用大肠杆菌尼氏菌株on14、on11和对照菌株on9(图5e)的109个细胞之后10天,初步发现所施用的细胞在小鼠的大肠中积累。在》108个cfu/g的情况下在近侧结肠中检测到最高浓度的on细胞(图7a),而在(《104个cfu/g)的情况下在小肠中检测到最少的on细菌。在中部结肠中,基于on细胞通过免疫组织化学与抗gfp抗体的可视化,将所述细胞沿粘膜层定位(图7b)。
[0204]
还测量了源自口服治疗的小鼠的血清、结肠组织和粪便的样品中trp、5-htp、5-ht和trm的水平。结肠组织和粪便而不是血清中的色氨酸水平升高,并且仅在小鼠体内口服施用了大肠杆菌尼氏菌株on14(图8a)。5-ht水平跨队列在血清和结肠组织中没有统计学差异(通过anova,p》0.4)。然而,与其它组相比,在施用了大肠杆菌尼氏菌株on14的小鼠体内粪便5-ht水平显著增加(13.4倍增加,通过anova,p《0.0001)(图8b).在所有样品中色胺和5-htp水平均低于检测限。
[0205]
尽管5-ht水平在结肠组织本身中未升高(在洗涤以除去残余消化物之后),但在施用了大肠杆菌尼氏菌株on14的小鼠体内沿结肠的粘膜层特别地检测到增加水平的血清素(图8c)。这些结果证明了在小鼠体内,口服施用的大肠杆菌尼氏菌株on14的细胞沿结肠的粘膜积累并且在体内产生5-ht。
[0206]
实例7:本发明的经遗传修饰的大肠杆菌菌株的口服施用引发肠道中的基因表达和生理学的变化
[0207]
向小鼠口服施用大肠杆菌尼氏菌株on14显示了可上调muc2表达并且增加粘膜增厚,这进而使粘膜完整性提高。源自肠嗜铬细胞的过量血清素可以刺激肠炎症。然而,即使在所治疗小鼠的结肠的粘膜层中检测到5-ht的水平增加(实例6),但这并未导致肠炎症、肠周转或肠屏障功能的标志物的表达发生变化(未示出)。
[0208]
在施用了大肠杆菌尼氏菌株on14的小鼠的结肠中宿主(小鼠)tph2表达而不是tph1增加,这表明细菌来源的5-ht可以诱导在小鼠的ens中的tph2介导的神经元5-ht生物合成。然而,这些小鼠体内的ec细胞(肠道中的宿主5-ht的主要产生物)的总数或大小未受到影响。
[0209]
尽管色氨酸和血清素代谢还可能影响其功能失调与许多神经病学和代谢病症相关的卡那霉素通路,但在施用了大肠杆菌尼氏菌株on14的小鼠的结肠中,在对将l-色氨酸转化为n-甲酰犬尿氨酸的限速酶进行编码的基因的表达中未检测到变化。
[0210]
7.1方法
[0211]
7.1.1口服施用:如6.1.1所述。
[0212]
7.1.2基因表达分析:根据实例6.1.4中的方案使组织冷冻断裂。然后根据制造商对rna分离的说明将组织重悬在trizol(英杰公司)中。使总rna重悬于30μl的无rna酶的水中。根据制造说明,利用iscript gdna clear cdna合成试剂盒(biorad 1725035)将rna转化为cdna。根据制造商说明在applied biosystems quantstudio6 flex real-time pcr系
统上在384孔板中一式三份执行定量实时聚合酶链反应(qpcr)。所使用的引物在表3中列出。使用了亲环蛋白作为管家基因。使用δδcτ方法对相对mrna水平进行定量。
[0213]
7.1.3薄切片中的免疫检测:如实例6.1.3所述。
[0214]
7.2结果
[0215]
与对照组相比,muc2基因在源自施用了大肠杆菌尼氏菌株on14的小鼠的结肠组织中的表达增加了约2倍(通过anova,p《0.05)(图9a)。对应地,用抗muc2抗体免疫组织化学染色的结肠组织的切片在施用了大肠杆菌尼氏菌株on14的小鼠体内显示出更突出的粘膜层(图9b)。结肠切片的苏木精和伊红染色进一步证实了与肠道炎症相关联的组织病理学变化的缺乏(未示出)。
[0216]
然而,在杯状细胞标志物cdx2或肠道干细胞标志物bm1和lgr5(未示出)的表达中未观察到差异,这表明muc2产生的杯状细胞和一般肠道周转没有变化。对应地,在施用了大肠杆菌尼氏菌株on14的小鼠的结肠组织(未示出)中未检测到通过qpcr的以下炎症标志物的基因表达水平的变化:il6、il1β、nfkβ、il17a和tnfα。此外,未观察到结肠长度的变化(通过anova,p=0.66),这是发现结肠长度缩短时慢性肠炎症的另一个指标(未示出)。tjp1、tjp2或ocln,用于维持结肠中的肠屏障的标志物的表达在施用了大肠杆菌尼氏菌株on14的小鼠体内也保持未改变(未示出)。
[0217]
虽然在tph1和sert的表达中未观察到差异,但与结肠中的其它组(通过anova,p《0.001)相比,在施用了大肠杆菌尼氏菌株on14的小鼠体内检测到tph2表达出乎意料地增加了2.8倍(图9a)。然而,检测到如通过qpcr和通过ec细胞标志物嗜铬粒蛋白a的免疫组织化学定量的ec细胞(肠道中的宿主5-ht的主要产物)的总数量或大小的变化(未示出)。
[0218]
另外,在施用了对将l-色氨酸转化为n-甲酰基犬尿氨酸的限速酶进行编码的大肠杆菌尼氏菌株on14的小鼠体内未检测到ido1、ido2和tdo2的表达变化(未示出)。
[0219]
实例8:本发明的经遗传修饰的大肠杆菌菌株的口服施用增强肠道中的血清素受体的表达和相关作用
[0220]
血清素是许多5-ht受体的配体,所述受体是介导整个ens、cns和外周神经系统中的兴奋性和抑制性神经传递的gpcr。cns中的5ht1b受体的配体激活与攻击性降低有关(de almeida等人,2002),并且与5htr1d一起,所述受体是基于色胺的偏头痛治疗的靶标受体(tepper等人,2002)。向小鼠口服施用大肠杆菌尼氏on11和on14两者示出可增加htr1b和htr1d基因表达,这表征可能有色胺介导的作用。
[0221]
5ht3受体具有多种生理作用,涉及呕吐、肠易激综合征(ibs)、精神分裂症、焦虑、学习、记忆和成瘾,并且在临床上受止吐剂5htr3拮抗剂调节(thompson等人,2007)。5ht4受体诱导肠内神经系统的神经发生,并且与gi道蠕动的调节、应激诱导的进食行为、学习和记忆改变以及cns的抑郁相关(gershon等人,(2007);lucas等人,(2007);lamirault等人,(2001))。虽然5htr7刺激可以改善认知和记忆(meneses等人,2015),并且5htr7拮抗性可以解决cns中的抗抑郁和抗精神病行为(roth,b.l.等人,1994),但对其在肠道中的功能并未完全理解,即使其与ibs和炎性肠病(ibd)有关(guseva,d.等人,2014)。鉴于5-ht受体的基因表达中的检测到的变化的多样性和幅度,合理的是大肠杆菌菌株on14引发宿主体内的生理应答。
[0222]
仅在on14队列中检测到htr3、htr4和htr7基因的表达上调,这表明有特定的血清
素介导的应答。
[0223]
另外,口服施用大肠杆菌尼氏菌株on14显示出可减少总gi传输,这与已知的通过诱导用于引起蠕动反射的腔内压和在空腹间隔期间扫过肠的结肠迁移运动复合体两者来调节gi运动的血清素一致。
[0224]
尽管肠道运动和细菌产生的生物源性胺的变化可能会影响肠道微生物组,但基于小鼠队列的粪便物的16s宏基因组测序,由于单独施用大肠杆菌尼氏菌株on14、on11、on9或pbs在小鼠队列之间未检测到肠道微生物组的显著变化(未示出)。总之,大肠杆菌尼氏菌株on14和on11的施用引发了肠道中的许多生理应答,包含宿主5-ht受体基因表达和gi运动,同时使常驻微生物群落不受干扰。
[0225]
8.1方法
[0226]
8.1.1口服施用:如6.1.1所述。
[0227]
8.1.2基因表达分析:如7.1.1所述。
[0228]
8.1.3总胃肠传输:使用了不能从肠道的管腔吸收的卡红来研究总gi传输时间。借助于通过21号圆尖端馈送针管饲来施用悬浮在0.5%甲基纤维素(西格玛奥德里奇公司)中的6%卡红(300μl;西格玛奥德里奇公司)溶液。将管饲发生的时间记录为t0。管饲之后,针对卡红的存在以10分钟间隔监测粪便团粒。总gi传输时间被视为是t0与在粪便中首次观察到卡红的时间之间的间隔。
[0229]
8.1.4基因组16s测序和分析:在第0天和第10天从小鼠收集粪便团粒,并且立即储存在-20℃下直到进行配对端测序为止。使用epicenter革兰氏阳性试剂盒加上用0.1mm氧化锆珠粒进行的初始珠粒敲击步骤从粪便团粒中提取基因组dna。根据先前的方案57进行16srrna v4区域的pcr扩增和样品的多重条形编码。根据来自kozich等人(2013)的方法,使用定制引物,用1x nebnext q5 hot start hifi pcr master mix对16s rrna基因的v4区域进行扩增。用illumina miseq系统(300v2试剂盒)进行测序。使用usearch v10.0.240_i86osx64制备测序对读数。将正向读数和反向读数配对并滤波到最小长度240,其中最大预期误差为1。对序列进行去复制,以2的最小簇大小进行聚类,并以97%的同一性58映射到otu。为otu分类法指定rdp分类器59。在conda内使用pynast将序列与qiime1、python 2.7、matplotlib 1.4.3进行比对。用rstudio包ape读取用fasttree构建的树。使用具有gglot2和phyloseq包的graphpad prism和rstudio执行otu数据分析和可视化。通过anisom使用具有phyloseq和vegan包的rstudio执行统计显著性。
[0230]
8.2结果
[0231]
在施用了大肠杆菌株on11和on14(通过anova,两者均为p《0.05)的小鼠体内检测到htr1b和htr1d基因的表达增加(图10a、b),而在施用了大肠杆菌菌株on14(通过anova,所有均为p《0.01)的小鼠的结肠中仅观察到htr3、htr4和htr7基因的表达降低(图10c-e)。
[0232]
此外,与对照队列相比,施用大肠杆菌菌株on14使经治疗的小鼠的总gi传输时间具体地减少多达15%(通过anova,p《0.05)(图10)。对源自小鼠队列的粪便物进行了16s宏基因组测序,之后在第0天和第11天施用单独的大肠杆菌尼氏菌株on14、on11、on9或pbs显示出从第0天到第11天在队列之间在肠道微生物组中无显著变化(r:0.07403,显著性:0.155,通过anisom)(未示出)。
[0233]
实例9:本发明的经遗传修饰的大肠杆菌菌株的口服施用降低小鼠的焦虑
[0234]
本发明的经遗传修饰的大肠杆菌on菌株的口服施用示出可诱导经治疗的小鼠的行为变化,所述行为变化可以通过肠道-脑轴线或通过外周和/或脑5-ht水平的增加介导。采用了两种良好确立的方法,即强迫游泳测试(fst)旷场测试(oft),来证明这些行为变化。通常用于评估抗焦虑药和抗抑郁药在啮齿动物体内的功效的fst通过记录在水填充的容器中静止所花费的时间来对行为绝望进行定量,作为逃离压力环境的绝望度的度量。oft通过检测总粪便球、行进的总距离以及探索50
×
50cm白色、光线好的开阔场地的内部和外部区域所花费的时间来测量焦虑水平以及在压力环境中探索的意愿。
[0235]
这些测试的结果表明,向小鼠口服施用大肠杆菌菌株on14对焦虑相关的疾病具有治疗作用。
[0236]
9.1方法
[0237]
9.1.1口服施用:如6.1.1中所述。
[0238]
9.1.2强迫游泳测试:将每只小鼠置于23-25℃下的具有15cm水的透明圆柱形水箱(30cm高度
×
20cm)中持续6分钟并且记录,如ferguson(2001)所述。然后对小鼠进行毛巾干燥并置于加热灯下以进行干燥以防止体温过低,并且然后放回其原来的笼子中。对记录解标识,并且盲观察者对在6分钟测试的最后4分钟期间静止所花费的时间的记录进行评分,如can等人(2012)所描述的。
[0239]
9.1.3旷场测试:将每只小鼠置于白色、开放式屋顶、光线好的50cm(长度)
×
50cm(宽度)
×
38cm(高度)的室中,并按照先前所述的方法记录10分钟(spohn,s.n.等人,2016)。然后将小鼠放回其原来的笼子中。对在10分钟测试期间产生的粪便团粒进行计数。然后对记录进行后处理和并且使用如先前所述的behaviorcloud进行分析(spohn,s.n.等人,2016)。小鼠跟踪软件记录每只小鼠的总移动路径、行进的总距离、在定义为内部40cm正方形的内区和定义为最靠近壁的外部10cm边界的外区中花费的时间、进入内区的次数以及在内区内行进的距离。
[0240]
9.2结果
[0241]
在施用单独的大肠杆菌尼氏菌株on14、on11、on9或pbs之后对小鼠队列执行fst和oft。
[0242]
在fst中,与施用了大肠杆菌菌株on的对照队列相比,施用了大肠杆菌尼氏菌株on14的小鼠队列表现出在fst期间的固定时间统计学上减少了至多17%(通过anova,p=0.004)(图11a)。此结果在单独且独立的动物队列中得到了有力的复制(未显示)。
[0243]
在oft中,施用了大肠杆菌尼氏菌株on14的小鼠队列显示出在十分钟测试期间粪便球的数量减少(图11b),这可能与压力降低或总gi传输减少相关联(图10f)。虽然野生型小鼠天然倾向于封闭、黑暗、狭窄的空间,但施用了大肠杆菌尼氏菌株on14的小鼠队列探索内部40
×
40cm区所花费的时间量增加并且在沿10
×
10cm外部区的边缘附近花费的时间减少(图11d、e),其中行进的总距离没有变化(图11c)。这些在oft中观察到的作用通过对另一小鼠队列(未示出)进行的oft得到了证实。对从具有不同初始肠道微生物群的不同商业供应商(杰克逊实验室(jackson laboratory))获得的小鼠进行的额外的oft也给出了与以上相似的生理和行为结果(未示出)。
[0244]
实例10:本发明的经遗传修饰的大肠杆菌菌株的口服施用的功效与小鼠体内的ssri相匹配
[0245]
以prozac和sarafem等品牌名称销售的氟西汀(fluoxetine)是通常使用的选择性血清素再摄取抑制剂(ssri)类的抗抑郁药。其用于治疗例如重度抑郁症、创伤后应激综合征(ptsd)和其它适应症。通过表明焦虑或压力的治疗性降低的在经治疗的小鼠中诱导行为变化的能力,本发明的经基因修饰的大肠杆菌on菌株的口服施用的功效显示出对应于氟西汀的施用。
[0246]
10.1方法:
[0247]
10.1.1施用:如6.1.1中针对口服施用所描述的,但具有以下修改:通过口服管饲向小鼠施用仅无菌pbs(pbs)或含新鲜生长的命名为on14的大肠杆菌尼氏菌株的109个细胞(包括pmut14-ser的大肠杆菌尼氏菌株on)的无菌pbs(on14)。另外,以200μl腹膜内(i.p.)注射向小鼠施用盐水或含ssri,10mg/kg体重氟西汀的盐水。小鼠每24小时在一天的同一时间接受口服和ip施用的共同治疗,持续21天。因此,四只小鼠治疗组接受:ip:盐水/管饲:pbs(阴性对照);ip:氟西汀/管饲:pbs(ssri阳性比较物),ip:盐水/管饲:on14(on14阳性比较物);以及ip:氟西汀/管饲:on14(阳性组合比较物)。最后施用之后24小时,使小鼠经受运动和行为测试。
[0248]
10.2结果
[0249]
用on14(ip:盐水/管饲:on14)治疗21天之后的小鼠表现出的表型与用氟西汀(ip:氟西汀/管饲)治疗的那些非常相似。如图12所示,a)用on14、氟西汀或组合疗法(ip:氟西汀/管饲:on14)两者观察到在oft期间产生的粪便球减少,这表明压力水平降低导致排便较少。进一步地,在图12b)-e)中,在内部区中花费的时间和行进的距离以及进入内部区中的总次数均通过on14或氟西汀治疗而增加。这些参数的增加被解释为焦虑或压力降低,并且表明在未知环境中探索的意愿增加。在强迫游泳测试(图12f)中,不移动所花费的时间作为绝望/抑郁的指示进行测量。on14和氟西汀治疗两者均显著减少静止的时间,这表明功效相似。与用氟西汀治疗的小鼠相比,经on14治疗的小鼠显示出在内部区中花费的时间、进入内部区和内部区中的距离方面类似的作用(图12)。与仅用on14或氟西汀治疗的个体组相比,用on14治疗和用氟西汀治疗的组合使总作用略有降低。
[0250]
实例11:本发明的经遗传修饰的大肠杆菌菌株的口服施用增加了血浆和尿液血清素
[0251]
向小鼠口服施用5-htp产生的大肠杆菌尼氏菌株on10显示出可增加小鼠体内的血浆血清素和尿液血清素以及5-htp浓度。
[0252]
11.1方法
[0253]
11.1.1口服施用:如6.1.1所述,具有以下修改:动物在管饲之前3天并且在整个实验中接受含链霉素(5g/l)的饮用水。单次口服管饲on10或不具有色氨酸羟化酶的对照ecn菌株(ecn_control)的108个细胞。每24小时通过腹膜内注射(ip)用tdc抑制剂卡比多巴对动物进行治疗,并且每天收集新鲜粪便样品,持续7天,之后对动物实施安乐死。在管饲之后第2天和第7天采集血浆样品。
[0254]
11.1:2体内代谢物分析:针对血清素、5-羟基色氨酸、色胺、5-羟基吲哚乙酸(5-hiaa)和色氨酸对血浆、组织、肠道内容物、尿液和粪便样品进行分析。对于血浆:通过管饲后第2天的下颌下静脉(并且通过第8天的心脏穿刺)收集血液样品,在锂-肝素微量容器中在冰上保持10分钟,并且然后通过在4℃下以10000g离心90秒来将血浆分离,并且将血浆
在-80c下速冻。在使样品解冻之后添加含有0.9%nacl、0.2%抗坏血酸和20mg/l c-13标记的色氨酸的内部标准缓冲液,并且使用甲醇提取来使蛋白质沉淀。在使用真空离心机对样品进行干燥之后,将其在50ul ddh2o中重构以用于lc-ms/ms分析。对于组织分析:在收集结肠组织后对其称重并立即冷冻在液氮中,并且使用不锈钢微瓶(biospec 2007)用单个6.34mm不锈钢珠(biospec 11079635ss)在beadbeater(biospec 112011)中敲击30秒以使其冷冻断裂。管饲之后第2天和第6天收集尿液,并且立即在-80℃下速冻。在使样品解冻之后添加含有0.9%nacl、0.2%抗坏血酸和20mg/l c-13标记的色氨酸的内部标准缓冲液,并且使用甲醇提取来使蛋白质沉淀。在使用真空离心机对样品进行干燥之后,将其在50ul ddh2o中重构以用于lc-ms/ms分析。
[0255]
11.2结果
[0256]
与不进行tph表达的对照菌株相比,在具有on10的血浆中观察到5-ht浓度显著增加(通过双尾t测试,p《0.001),这证明了体内5-htp的on10衍生的产生成功(图13a)。由on10产生的5-htp的量足以升高外周血浆血清素浓度,同时使色氨酸浓度不受影响(图13b),这表明on10在生理相关水平内对血清素代谢的特定作用。所有样品中5-htp的血浆浓度均低于定量水平;然而,由于已知5-htp可穿过血脑屏障,因此外周产生的5-htp能够增加脑中血清素生物合成,其中对情绪、睡眠、焦虑和其它病症具有潜在治疗作用(turner等人,2006)。on10菌株呈现了一种用于以恒定剂量从gi道内递送5-htp,从而避免5-htp和5-ht等神经递质的剂量依赖性波动的不期望的作用。
[0257]
与对照组相比,尿液5-ht和5-htp浓度也随着on10增加(分别为图13c和d),这示出随着on10的血清素代谢增加。
[0258]
实例12:经遗传修饰的酿酒酵母细胞表达用于5-ht产生的生物合成通路
[0259]
通过引入重组基因对酿酒酵母(saccharomyces cerevisiae、s.cerevisiae)进行遗传修饰以建立包括用于催化trp转化为5-htp并且然后5-htp转化为5-ht的两个连续代谢步骤的酶的合成血清素通路(图1)。通过表达和确定可从tph和tdc基因的组合获得的5-ht产率来确定对用于催化这两个代谢步骤的最佳酶组合的鉴定。
[0260]
12.1方法
[0261]
经修饰的酿酒酵母细胞如下工程化,参照表1:
[0262]
从mans等人,(2015)获得宿主菌株酿酒酵母。对源自哺乳动物、植物或细菌来源:小鼠tph1(m1)和水稻tdc(r)的tph蛋白进行编码的基因与1.1.1中相同。还对来自细菌暂定万能科里氏菌ellin345(ck)的不同tdc基因进行了测试。将通路基因克隆到酵母2μ质粒骨架或ars/cen骨架中(见图14)。在pkg1启动子的控制下对m1基因进行克隆,并且通过tef1启动子对tdc基因(水稻tdc或ck tdc)进行控制。随后通过采用本领域已知的标准克隆和转换程序将质粒转换到宿主菌株中。
[0263]
如下确定生长和体外代谢物产生:使酵母菌株在合成完全营养缺陷型(synthetic complete dropout,sc)培养基(不具有氨基酸的酵母氮基6.7g/l、葡萄糖20g/l,营养缺陷型混合物2g/l)中生长。使用的营养缺陷型混合物缺乏组氨酸,由此保留了质粒。使阴性对照(不含有质粒)与20mg/l组氨酸一起生长。从每个菌株中挑取三个单独菌落,使其在24深孔板中在2mlμl培养基中生长,并且在30℃下以250rpm摇动持续48小时。在摇瓶中在25ml sc培养基+500mg/l色氨酸中将主要培养物接种到od
600
=0.05,并且使细胞在相同的条件下
生长72小时。之后,通过在17000
×
g下离心2分钟将培养物上清液与细胞分离,并且在通过hplc进行分析之前冷冻在-20℃下。显示的所有数据为来自至少3个生物重复的平均值+/-sd。
[0264]
如在1.1.3中通过lc-ms对代谢物产生进行定量。
[0265]
12.2结果:
[0266]
被工程化为表达小鼠tph1(m1)的宿主酿酒酵母的经遗传修饰的菌株与来自水稻(r)的tdc[或来自细菌暂定万能科里氏菌ellin345(ck_tdc)的细菌tdc基因]的组合产生了显著量的血清素(图15a)。而在不具有tph或tdc基因表达的对照菌株(sc_control)中,未检测到血清素产生(通过anova,p《0.0018),表达小鼠tph1和r-tdc(psc-1和psc-2)或ck-tdc(psc-3)的菌株(见表1)分别产生了大约0.38+/-0.07mg/l和0.52+/-0.06mg/l的血清素。ck-tdc基因还可以功能性地替代r-tdc基因,并且使得能够在大肠杆菌构建体中产生血清素(图15b),但ck-tdc的强烈过表达会在on中产生细胞毒性(图15c),从而导致与r-tdc表达相比,生长速率和最终生物质产率降低。
[0267]
实例13:经遗传修饰的枯草芽孢杆菌168细胞表达用于5-ht产生的生物合成通路
[0268]
通过引入重组基因以建立包括用于催化trp转化为5-htp并且然后5-htp转化为5-ht的两个连续代谢步骤的酶的合成血清素通路来对枯草芽孢杆菌(bacillus subtilis、b.subtilis)进行遗传修饰(图1)。通过表达和确定可从tph和tdc基因的组合中获得的5-ht产率来确定对用于催化这两个代谢步骤的最佳组合酶的鉴定。
[0269]
13.1方法
[0270]
如下对从德国微生物和细胞培养物保藏中心(dsmz)[nc_000964]获得的宿主菌株枯草芽孢杆菌168进行基因工程化,参考表1:对源自哺乳动物或植物来源:小鼠tph1(m1)和水稻tdc(r)的tph蛋白进行编码的基因与1.1.1中相同。将所测试的tph和tdc基因组合连同大肠杆菌fole基因的t198i变体一起克隆到整合质粒(源自pdg364,见表1)中以促进通路操纵子的基因组整合。将基因置于合成操纵子中,所述合成操纵子由强芽孢杆菌特异性启动子(ps11)、m1的强rbs(r01)、tdc的中等强度rbs(来自表1的rbs 50)和fole(t198i)的强rbs(r11)组成。质粒pbs-m1rf含有小鼠tph1、水稻tdc和fole(t198i)基因(图16)。
[0271]
通过采用标准分子生物学方法在大肠杆菌top10中执行克隆。随后通过采用本领域已知的标准克隆和转换程序将质粒转换到宿主菌株中。通过桑格尔测序(sanger sequencing)对枯草芽孢杆菌168基因组在amye基因座中的正确通路集成进行验证。
[0272]
如下确定生长和体内代谢物产生:使枯草芽孢杆菌168菌株在含有0.2%(w/v)葡萄糖和50mg/l的l-色氨酸的溶原性肉汤(lb)培养基中生长。从每个菌株中挑取三个单独菌落,使其在96深孔板中在300μl培养基中生长,并且在37℃下以250rpm振荡持续16小时。通过将这种预培养物1:100稀释到新鲜培养基中来接种主要培养物,并且使细胞在相同条件下生长24小时。之后,使用0.2μm孔径过滤器将培养物上清液与细胞分离,并且在通过lc-ms进行分析之前冷冻在-20℃下。显示的所有数据为来自至少3个生物重复的平均值+/-sd。
[0273]
如在1.1.3中通过lc-ms对代谢物产生进行定量。
[0274]
13.2结果:
[0275]
宿主枯草芽孢杆菌168的被工程化为表达小鼠tph1(m1)的经遗传修饰的菌株与来自小鼠(r)和大肠杆菌fole(t198i)的tdc的组合预期产生血清素和5-htp。
[0276]
使用野生型枯草芽孢杆菌168菌株未产生5-htp或5-ht,同时色氨酸羟化酶m1与fole(t198i)一起进行的表达将实现5-htp产生。m1_tph、fole(t198i)和r_tdc的表达预期会引起血清素的产生。
[0277]
表1:实例中使用的菌株、质粒和基因
[0278]
[0279]
[0280][0281]
表2:实例中使用的rbs变体
[0282]
[0283][0284]
表3:实例中使用的qpcr引物
[0285]
[0286][0287]
参考文献
[0288][0289]
baba,t.等人“大肠杆菌k-12框内单基因敲除突变体的构建:keio文库(construction of escherichia coli k-12in-frame,single-gene knockout mutants:the keio collection.)”《分子系统生物学(mol syst biol)》2,2006 0008(2006)。
[0290]
blin,k.、pedersen,l.e.、weber,t.和lee,s.y.“crispy网页:用于针对crispr应用设计sgrna的在线资源(crispy-web:an online resource to design sgrnas for crispr applications.)”《合成与系统生物技术(synth syst biotechnol)》1,118-121
(2016)。
[0291]
blum-oehler,g.等人“用于检测粪便样品中的益生菌大肠杆菌菌株尼氏1917的菌株特异性pcr反应的发展(development of strain-specific pcr reactions for the detection of the probiotic escherichia coli strain nissle 1917in fecal samples.)”《微生物学研究(res microbiol)》154,59-66(2003)。
[0292]
browning,kn.“迷走神经中枢5-ht3受体在胃肠生理和病理生理中的作用(role of central vagal 5-ht3 receptors in gastrointestinal physiology and pathophysiology.)”《神经科学前沿(front neurosci.)》;9:413(2015)。
[0293]
breit,s等人,“迷走神经在精神病学和炎性疾病中的脑-肠道轴线的调节器(vagus nerve as modulator of the brain
–
gut axis in psychiatric and inflammatory disorders)”《精神病学前沿(front psychiatry)》;9:44.(2018)。
[0294]
can,a.、dao,d.t.、arad,m.、terrillion,c.e.、piantadosi,s.c.、gould,t.d.“小鼠强迫游泳测试(the mouse forced swim test.)”《视觉实验杂志(j.vis.exp.)》(59)(2012)。
[0295]
casteleyn,c.、rekecki,a.、van der aa,a.、simoens,p.和van den broeck,w.“作为从小鼠到人的服剂量转换的先决条件的鼠肠道表面积评估(surface area assessment of the murine intestinal tract as a prerequisite for oral dose translation from mouse to man.)”《实验室动物(lab.anim.44,176
–
83(2010)。
[0296]
de almeida、r.m.和miczek,k.a.“通过社会煽动或通过停止对小鼠的强化(“挫败”)而升级的攻击:通过安匹托林:一种5-ht1b受体激动剂进行的抑制(aggression escalated by social instigation or by discontinuation of reinforcement("frustration")in mice:inhibition by anpirtoline:a 5-ht1b receptor agonist.)”《神经精神药理学(neuropsychopharmacology)》27,171-181(2002)。
[0297]
ferguson,j.m.“ssri抗抑郁药物:不良反应和耐受性(ssri antidepressant medications:adverse effects and tolerability.)”《临床精神病学杂志初级护理指南(prim care companion j clin psychiatry)》3,22-27(2001)。
[0298]
gershon,m.d.和liu,m.t.“血清素与功能性肠病的神经保护(serotonin and neuroprotection in functional bowel disorders.)”《神经胃肠病学和运动性(neurogastroenterol motil)》19增刊2,19-24(2007)。
[0299]
gibson,d.g.等人“至多几百千碱基的dna分子的酶学组装(enzymatic assembly of dna molecules up to several hundred kilobases.)”《自然方法(nat methods)》6,343-345(2009)。
[0300]
guiziou,s.等人“调节枯草芽孢杆菌的基因表达的部分工具箱(a part toolbox to tune genetic expression in bacillus subtilis.)”《核酸研究(nucleic acids)》res.44,7495
–
7508(2016)。
[0301]
guseva,d.等人“血清素5-ht7受体主要参与胃肠道的急性和慢性炎症(serotonin 5-ht7receptor is critically involved in acute and chronic inflammation of the gastrointestinal tract.)”《炎性肠病(inflamm bowel dis)》20,1516-1529(2014)。
[0302]
hoa,n.t.、brannigan,j.a.和cutting,s.m.“枯草芽孢杆菌信号传导蛋白spoivb
microbiol)》6,39(2006)。
[0312]
mehrer,c.r.、incha,m.r.、politz,m.c.和pfleger,b.f.“通过β还原通路厌氧产生培养基链脂肪醇(anaerobic production of medium-chain fatty alcohols via a beta-reduction pathway.)”代谢工程(metab eng)》48,63-71(2018)。
[0313]
meneses,a.等人“5-ht7受体激活:前认知和抗遗忘作用(5-ht7 receptor activation:procognitive and antiamnesic effects.)”《精神药理学(psychopharmacology)》(berl)232,595-603(2015)。
[0314]
meneses,a.“血清素、神经标志物和记忆(a.serotonin,neural markers,and memory.)”《药理学前沿(front.pharmacol.)》,(2015)。
[0315]
roth,b.l.等人“5-羟色胺-6和5-羟色胺-7受体的典型和非典型抗精神病药物的结合(binding of typical and atypical antipsychotic agents to 5-hydroxytryptamine-6and 5-hydroxytryptamine-7receptors.)”《药理学与实验治疗学杂志(j pharmacol exp ther)》268,1403-1410(1994)。
[0316]
salis,h.m.、mirsky,e.a.和voigt,c.a.“用于控制蛋白质表达的合成核糖体结合位点的自动化设计(automated design of synthetic ribosome binding sites to control protein expression.)”《自然生物技术(nat biotechnol)》27,946-950(2009)。
[0317]
schirmaier,f.和philippsen,p.“用于对酿酒酵母的翻译伸长因子ef-1α进行编码的两个基因的鉴定(identification of two genes coding for the translation elongation factor ef-1alpha of s.cerevisiae.)”《embo杂志(embo j.)》3,3311-3315(1984)。
[0318]
sender,r.,、fuchs,s.和milo,r.“对身体内的人细胞和细菌细胞的数量的修正估计(revised estimates for the number of human and bacteria cells in the body.)”《公共科学图书馆
·
生物学(plos biol.)》14,e1002533(2016)。
[0319]
spohn,s.n.等人“上皮5-羟色胺4受体在正常和炎症结肠中的保护作用(protective actions of epithelial 5-hydroxytryptamine 4receptors in normal and inflamed colon.)”《肠胃病学(gastroenterology)》151,933-944e933(2016)。
[0320]
tepper,s.j.、rapoport,a.m.和sheftell,f.d.“5-ht1b/1d受体激动剂的作用机制(mechanisms of action of the 5-ht1b/1d receptor agonists.)”《神经病学档案(arch neurol)》59,1084-1088(2002)。
[0321]
thompson,a.j.和lummis,s.c.“作为治疗靶标的5-ht3受体(the 5-ht3 receptor as a therapeutic target.)”《关于治疗靶点的专家意见(expert opin ther targets)》11,527-540(2007)。
[0322]
turner,e.h.、loftis,j.m.和blackwell,a.d.“血清素a la carte:用血清素前体5-羟色氨酸进行补充(serotonin a la carte:supplementation with the serotonin precursor 5-hydroxytryptophan.)”《药理学与治疗学(pharmacology and therapeutics)》109,325
–
338(2006)。
[0323]
van rensburg,p.、van zyl,w.h.和pretorius,i.s.“用于高效纤维素降解的工程酵母(engineering yeast for efficient cellulose degradation.)”《酵母(yeast)》14,67
–
76(1998)。
[0324]
zou等人,1,520“来自所培养人类肠道细菌的参考基因组实现了功能性微生物组分析(reference genomes from cultivated human gut bacteria enable functional microbiome analyses.)”《自然生物学技术》37,179
–
185(2019)。
- 吗啉-茚酮-查尔酮衍生物荧光...
- 一种双色发泡鞋底及其制备工艺...
- 猕猴桃AaPG18基因及针对...
- 一种用于美白的水母肽及其制备...
- DNA荧光探针、采用DNA荧...
- 用于基底上的单分子放置的组合...
- 一种1-萘基异氰酸酯的制备方...
- 用于检测阿尔茨海默病的基因标...
- 一种通过构建生物级联反应合成...
- 一种抑制病毒蛋白酶活性的方法
- 还没有人留言评论。精彩留言会获得点赞!