辣椒素衍生物的合成的制作方法
1.本发明涉及辣椒素衍生物的合成,具体涉及辣椒素的6-庚炔衍生物的合成。
背景技术:
2.辣椒素的6-庚炔衍生物,本文称为capsaicyn,是具有各种潜在用途的有价值的化合物。与天然化合物辣椒素不同的是,它们的炔烃部分替代了辣椒素的烯烃部分,这些合成辣椒素衍生物在各个领域都有应用,包括食品工业、农业、药理学和海洋防污涂料。可能最广泛使用的衍生物,苯基辣椒素n-[(4-羟基-3-甲氧基苯基)甲基]-7-苯基-6-庚炔酰胺,已被证明具有低全身毒性且在基因突变和染色体损伤方面是安全的(rage paulsen et al.,toxicology research and application 2018,2,1),并且已经通过欧洲食品安全局(european food safety authority)的检查并被认为是安全的(efsa nda panel et al.,efsa journal 2019,17(6),e05718)。
[0003]
capsaicyn的生产需要多步骤化学合成。对于商业产品,重要的是合成是有效且经济的。优选地,合成还具有很少的合成步骤和分离的中间体,并且是可持续的以及具有低环境影响。
[0004]
先前描述的capsaicyn的合成通常依赖于相应的7-取代的6-庚炔酸或酰基氯与香兰素胺(vanillylamine)的偶联。
[0005]
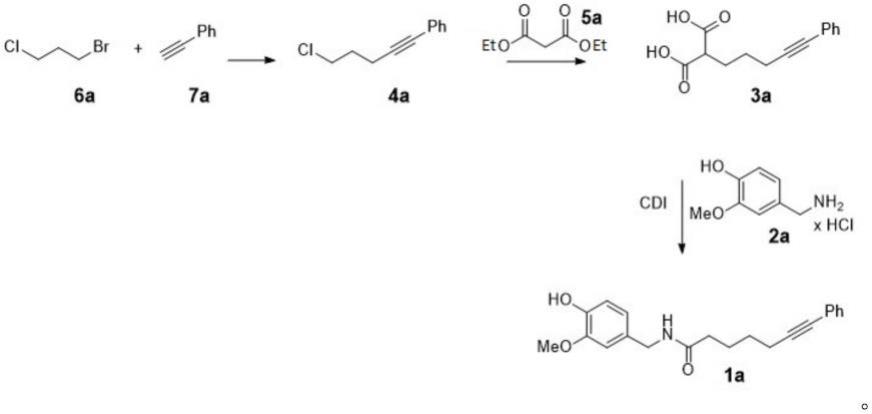
在他们的专利ep 1670310 b1中,申请人描述了capsaicyn的6步合成,在苯基辣椒素(1a)的方案1中示出。
[0006][0007]
方案1
[0008]
ep 1670310 b1中公开的合成路线从5-氯-1-戊醇开始,产生45%的总产率。在这个合成中,如在辣椒素本身的几个报道的合成中一样,亚硫酰氯,一种在与水或其他试剂接触时会剧烈释放有害气体的腐蚀性和反应性化合物,被用于关键步骤。
[0009]
cn 108947863中提供的合成路线也依赖于在关键步骤中使用亚硫酰氯。
[0010]
cordova等人在wo 2015/144902中的合成路线从苯基辣椒素的6-庚炔酸产生78%的产率,但在第一步骤中依赖钯催化,催化剂负载为相当可观的3%。路线示出在方案2中。合成界对于摆脱使用贵金属催化剂的兴趣日益增加,因为对低丰度贵金属的持续需求不仅引发了经济问题,而且对环境具有重大影响(ludwig and schindler,chem 2017,2,313)。cordova等人报道的高催化剂负载使得该合成在商业规模上进行是非常昂贵的。此外,6-庚炔酸的合成相对冗长,参见russian chemical bulletin 2001,50(5),833。
[0011][0012]
方案2
[0013]
对于辣椒素本身和不含6-炔部分的辣椒素衍生物的合成,值得注意的合成路线包括经由酰基氯的亚硫酰氯依赖路线,类似于方案1中的路线(参见例如us 2007/0293703),以及钯催化(例如cn 107188818)和酶促(例如eo 2016/171538)偶联相应的酸,以及专注于引入双键的方法,包括维蒂希(wittig)反应和克莱森(claisen)酯重排。
[0014]
本发明的目的是提供capsaicyn的替代合成路线,诸如苯基辣椒素类的合成路线,诸如苯基辣椒素的合成路线,诸如比先前描述的路线更经济、更安全、更可持续和/或更环境友好以及不含贵金属催化剂的合成路线。
技术实现要素:
[0015]
发明人已经发现了capsaicyn的新合成路线。该路线在方案3中示出。
[0016]
新路线以三个合成步骤从便捷可得的原材料中提供capsaicyn。只有两个分离的中间体,该路线以其简短性和简单性而具有吸引力。与ep 1670310b1中描述的较长路线相比,由于需要更少的溶剂和更少的试剂,因此该路线的简短性使其更加经济和环境友好。低数量的合成步骤也意味着每时间单位和反应器体积的产物产量是有利的,并且很少的分离中间体减少了操作人员对化学品的暴露。该合成路线不含任何金属催化剂,使其比wo 2015/144902中公开的路线更可持续。
[0017][0018]
方案3
[0019]
对于给定的合成路线,r、r'、alk、lg和lg'中的每一个表示该合成路线的所有化合物中的相同取代基。
[0020]
在所呈现的化合物中,r可以是选自包括以下项的组的取代基:c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基;以及取代的苯基,其中苯基环在任何一个或多个位置中被选自包括以下项的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基、硝基、三氟甲基、c
1-c6直链和支链烷氧基、c
1-c6磺酰氧基、-s-c
1-c6烷基、c
1-c6直链和支链烷基、c
2-c6直链和支链烯基、c
2-c6直链和支链炔基、c
1-c6氟烷基、氯烷基、溴烷基和碘烷基、coo-c
1-c6烷基和con(c
1-c6烷基)2。
[0021]
r’可以代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自包括以下项的组:氟;氯;溴;碘;羟基、氰基、氨基、硝基、三氟甲基、c
1-c6直链和支链烷氧基、c
1-c6磺酰氧基、-s-c
1-c6烷基、c
1-c6直链和支链烷基、c
2-c6直链和支链烯基、c
2-c6直链和支链炔基、c
1-c6氟烷基、氯烷基、溴烷基和碘烷基、cooh、conh2、-nhco(c
1-c6烷基)、coo-c
1-c6烷基、conh(c
1-c6烷基)和con(c
1-c6烷基)2。
[0022]
alk代表c
1-c6直链、支链或环状烷基。两个alk基团可以是相同的。
[0023]
lg和lg’代表离去基团,可以是彼此相同或不同的,选自包括但不限于以下项的列表:全氟烷基磺酸酯基诸如三氟甲磺酸酯基;磺酸酯基诸如甲苯磺酸酯基、甲磺酸酯基;以及氟;氯;溴和碘。
[0024]
本发明提供制备通式1的辣椒素的6-庚炔衍生物的方法,其中,r是选自包括以下项的组的取代基:c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基;以及取代的苯基,其中所述取代的苯基环在任何一个或多个位置中被选自包括以下项的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基、硝基、三氟甲基、c
1-c6直链和支链烷氧基、c
1-c6磺酰氧基、-s-c
1-c6烷基、c
1-c6直链和支链烷基、c
2-c6直链和支链烯基、c
2-c6直链和支链炔基、c
1-c6氟烷基、氯烷基、溴烷基和碘烷基、coo-c
1-c6烷基和con(c
1-c6烷基)2;以及r’代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自包括以下项的组:氟;氯;溴;碘;羟基、氰基、氨基、硝基、三氟甲基、c
1-c6直链和支链烷氧基、c
1-c6磺酰氧基、-s-c
1-c6烷基、c
1-c6直链和支链烷基、c
2-c6直链和支链烯基、c
2-c6直链和支链炔基、c
1-c6氟烷基、氯烷基、溴烷基和碘烷基、cooh、conh2、-nhco(c
1-c6烷基)、coo-c
1-c6烷基、conh(c
1-c6烷基)和con(c
1-c6烷基)2,所述方法包括以下步骤:使用1,1'-羰基二咪唑(cdi),将通式3的化合物与通式2的苄胺或其任何合适的盐偶联,其中,2和3的r和r’如式1中定义。
[0025]
本发明进一步提供制备如上描述的通式1的辣椒素的6-庚炔衍生物的方法,其中,所述方法进一步包括在先前描述的步骤之前的以下步骤:使通式4的化合物与通式5的丙二酸烷基酯反应,其中4的r如式3中定义,以产生通式3的所述化合物;其中,alk表示直链、支链或环状c
1-c6烷基基团;以及lg表示本领域技术人员熟知的任何离去基团。
[0026]
本发明还提供制备如上描述的通式1的辣椒素的6-庚炔衍生物的方法,其中,所述方法进一步包括在先前描述的步骤之前的以下步骤:使通式7的乙炔化合物与通式6的1,3-取代的丙烷化合物反应,其中,6和7的lg和r如式4中定义,以产生通式4的所述化合物;其中,lg和lg’是不同或相同的离去基团,选自包括以下项的列表:全氟烷基磺酸酯基诸如三氟甲磺酸酯基;磺酸酯基诸如甲苯磺酸酯基、甲磺酸酯基;氟;氯;溴和碘。
具体实施方式
[0027]
除非另有定义,否则本文使用的所有技术术语、符号和其他科学术语或专业名词旨在具有本发明所属领域的技术人员通常理解的含义。在一些情况下,为了清楚和/或为了便于参考,本文定义了具有普遍理解含义的术语,并且本文中包含的此类定义不一定被解释为代表与本领域通常理解的内容的实质性差异。
[0028]
如本文所用,术语“capsaicyn”是指通式1的辣椒素的6-庚炔衍生物。
[0029][0030]
技术人员知道术语“6-庚炔”和“庚-6-炔”,两者在化学命名法中都是常见的,可以互换使用并且具有相同的含义。本文选择使用术语“6-庚炔”和相关的命名法,诸如“6-庚炔酸(6-heptynoic)”等,单纯是为了可读性的目的。
[0031]
读者应注意,本领域中辣椒素衍生物使用的命名法并不一致,并且虽然为了便于阅读,当提及一般化合物组时使用术语capsaicyn,但当提及n-[(4-羟基-3-甲氧基苯基)甲基]-7-苯基-6-庚炔酰胺时,将使用公认的常用名“苯基辣椒素”,并且“苯基辣椒素类”将用
于指代其衍生物。
[0032]
如本文所用,术语“衍生物”是指化学结构不同于母体化合物的分子。衍生物的实例包括但不限于:同系物,其与母体的化学结构逐渐不同,诸如脂肪链长度的差异;分子片段;一个或多个官能团与母体化合物不同的结构,诸如可以通过转化母体的一个或多个官能团来制备;母体电离状态的变化,诸如将酸电离为其共轭碱;异构体,包括位置、几何和立体异构体;及其组合。
[0033]
如本文所用,术语“c
1-c6烷基”是指1至6个碳原子的直链和支链脂肪族基团,诸如甲基、乙基、丙基、异丙基、丁基、叔丁基、仲丁基、异丁基、戊基、己基等。术语“c1–
c6直链和支链烷氧基”是指甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、仲丁氧基、异丁氧基和叔丁氧基等。
[0034]
如本文所用,术语“溶剂”是指液体物质,其中化合物在给定浓度下可溶或部分可溶,以足以溶解或部分溶解化合物。除非上下文另有说明,否则该术语既指溶剂共混物(即由多种成分组成的溶剂)也指纯化合物(即由单一成分组成的溶剂)。
[0035]
如本文所用,术语“无水溶剂”是指包含按重量计小于0.5%的水的溶剂,优选在反应期间在氮气或氩气下保持和处理。
[0036]
如本文所用,术语“无水条件”是指在反应混合物中避免任何显著量的水分,诸如反应混合物包含按重量计少于0.5%的水,但并不旨在意指完全不存在任何水分。
[0037]
如本文所用,术语“碱”意指能够接受质子的化合物。
[0038]
如本文所用,术语“同时”是指同时或大致同时发生的任何两个或更多个过程,并不严格理解。这并不旨在过程需要一起开始或一起结束。
[0039]
如本文所用,术语“淬灭反应混合物”意指使试剂失活,和/或停止反应,和/或开始反应混合物的后处理(work-up)。
[0040]
无论任何取代基的优先级如何,苯基环均从ipso碳(1)开始从1至6循环编号。
[0041]
本领域技术人员清楚的是,根据本发明,使用所公开的制备辣椒素的6-庚炔衍生物的方法,不仅可以合成本文公开的化合物,而且也可以合成呈各种立体异构形式的大范围的衍生物、类似物和/或盐。
[0042]
本领域技术人员还清楚的是,在本文公开的任何反应中获得的产物可以呈溶剂化物诸如水合物的形式,和/或可以包含杂质。技术人员了解用于去除任何溶剂残留物的一系列不同技术。技术人员了解一系列不同的纯化技术。
[0043]
在一些实施方式中,本发明提供了一般结构1的capsaicyn的合成路线,其中,r是选自包括以下项的组的取代基:氢、c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基;和取代的苯基;
[0044]
其中,所述取代的苯基在任何一个或多个位置中被选自包括以下项的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基、硝基、三氟甲基、c
1-c6直链和支链烷氧基、c
1-c6磺酰氧基、-s-c
1-c6烷基、c
1-c6直链和支链烷基、烯基和炔基、c
2-c6直链和支链烯基、c
2-c6直链和支链炔基、c
1-c6氟烷基、氯烷基、溴烷基和碘烷基、coo-c
1-c6烷基和con(c
1-c6烷基)2;以及
[0045]
r’代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自包括以下项的组:氟;氯;溴;碘;羟基、氰基、氨基、硝基、三氟甲基、c
1-c6直链和支链烷氧基、c
1-c6磺酰氧
基、-s-c
1-c6烷基、c
1-c6直链和支链烷基、烯基和炔基、c
1-c6氟烷基、氯烷基、溴烷基和碘烷基、cooh、conh2、-nhco(c
1-c6烷基)、coo-c
1-c6烷基、conh(c
1-c6烷基)和con(c
1-c6烷基)2。
[0046]
在一些实施方式中,本发明提供了一般结构1的capsaicyn的合成路线,其中,r是选自由以下项组成的组的取代基:氢、c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基;和取代的苯基;
[0047]
其中,所述取代的苯基在任何一个或多个位置中被选自由以下项组成的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基、硝基、三氟甲基、c
1-c6直链和支链烷氧基、c
1-c6磺酰氧基、-s-c
1-c6烷基、c
1-c6直链和支链烷基、烯基和炔基、c
2-c6直链和支链烯基、c
2-c6直链和支链炔基、c
1-c6氟烷基、氯烷基、溴烷基和碘烷基、coo-c
1-c6烷基和con(c
1-c6烷基)2;以及
[0048]
r’代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自由以下项组成的组:氟;氯;溴;碘;羟基、氰基、氨基、硝基、三氟甲基、c
1-c6直链和支链烷氧基、c
1-c6磺酰氧基、-s-c
1-c6烷基、c
1-c6直链和支链烷基、烯基和炔基、c
1-c6氟烷基、氯烷基、溴烷基和碘烷基、cooh、conh2、-nhco(c
1-c6烷基)、coo-c
1-c6烷基、conh(c
1-c6烷基)和con(c
1-c6烷基)2。
[0049]
所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基;硝基;三氟甲基;c
1-c6直链和支链烷氧基;c
1-c6磺酰氧基;-s-c
1-c6烷基;c
1-c
12
直链和支链烷基、烯基和炔基;c
1-c6氟烷基、氯烷基、溴烷基和碘烷基;coo-c
1-c6烷基和con(c
1-c6烷基)2。这种变体表示为a1。
[0050]
所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基;硝基;三氟甲基;c
1-c6直链和支链烷氧基;c
1-c6磺酰氧基;-s-c
1-c6烷基;c
1-c
12
直链和支链烷基、烯基和炔基;以及c
1-c6氟烷基、氯烷基、溴烷基和碘烷基。这种变体表示为a2。
[0051]
所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基;硝基;和三氟甲基。这种变体表示为a3。
[0052]
所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;c
1-c
12
直链和支链烷基、烯基和炔基;以及c
1-c6直链和支链烷氧基。这种变体表示为a4。
[0053]
所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;c
1-c
10
直链和支链烷基、烯基和炔基;以及c
1-c6直链和支链烷氧基。这种变体表示为a5。
[0054]
所述取代的苯基环可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:c
1-c6直链和支链烷基、烯基和炔基;以及c
1-c4直链和支链烷氧基。这种变体表示为a6。
[0055]
所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:c
1-c6直链和支链烷基、烯基和炔基;以及c
1-c6氟烷基、氯烷基、溴烷基和碘烷基。这种变体表示为a7。
[0056]
所述取代的苯基可以具有一个取代基,诸如在2-位置,诸如在3-位置,诸如在4-位置。所述苯基环可以具有两个取代基,诸如在位置2和6,诸如在位置2和5,诸如在位置2和3,
诸如在位置3和5,诸如在位置2和4,诸如在位置3和4。所述苯基环可以具有三个取代基,诸如在位置2、3和6,诸如在位置2、4和6,诸如在位置2、3和4,诸如在位置2、3和5,诸如在位置3、4和5。所述苯基环可以具有四个取代基,诸如在位置2、3、4和6,诸如在位置2、3、4和5,诸如在位置2、3、5和6。所述苯基环可以具有五个取代基。
[0057]
在一些变体中,取代的苯基上的所述取代基中的两个彼此相同。在一些变体中,取代基中的三个彼此相同。在一些变体中,取代基中的四个彼此相同。在一些变体中,取代基中的五个彼此相同。在一些变体中,所述取代基全部彼此相同。
[0058]
r可以选自包括以下项或由以下项组成的组:氢;c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基;以及如上所限定的取代的苯基。这种变体表示为b1。
[0059]
r可以选自包括以下项或由以下项组成的组:c
1-c
18
直链和支链烷基、烯基和炔基;苯基;以及如上所限定的取代的苯基。这种变体表示为b2。
[0060]
r可以选自包括以下项或由以下项组成的组:氢;c
1-c
10
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c8环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基;以及如上所限定的取代的苯基。这种变体表示为b3。
[0061]
r可以选自包括以下项或由以下项组成的组:c
1-c6直链和支链烷基、烯基和炔基;三氟甲基;c
3-c6环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基;以及如上所限定的取代的苯基。这种变体表示为b4。
[0062]
r可以选自包括以下项或由以下项组成的组:c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;氟;氯;溴;碘;苯基;以及如上所限定的取代的苯基。这种变体表示为b5。
[0063]
r可以选自包括以下项或由以下项组成的组:c
1-c
10
直链和支链烷基、烯基和炔基;c
3-c8环烷基;以及苯基。这种变体表示为b6。
[0064]
优选地,r是未取代的苯基环。这种变体表示为b7。
[0065]
描述为包括取代的苯基的所有变体可以包括取代的苯基环的变体a1-a7中的任何一个,产生以下r基团:
[0066]
a1+b1、a1+b2、a1+b3、a1+b4、a1+b5、a2+b1、a2+b2、a2+b3、a2+b4、a2+b5、a3+b1、a3+b2、a3+b3、a3+b4、a3+b5、a4+b1、a4+b2、a4+b3、a4+b4、a4+b5、a5+b1、a5+b2、a5+b3、a5+b4、a5+b5、a6+b1、a6+b2、a6+b3、a6+b4、a6+b5、a7+b1、a7+b2、a7+b3、a7+b4、a7+b5、b6、b7。
[0067]
字母-数字组合是指上文限定的变体,使得例如
[0068]
a1+b1意指r可以选自包括以下项或由以下项组成的组:氢、c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基和取代的苯基(b1);其中,所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基;硝基;三氟甲基;c
1-c6直链和支链烷氧基;c
1-c6磺酰氧基;-s-c
1-c6烷基;c
1-c
12
直链和支链烷基、烯基和炔基;c
1-c6氟烷基、氯烷基、溴烷基和碘烷基;coo-c
1-c6烷基和con(c
1-c6烷基)2(a1);以及
[0069]
a7+b5意指r可以选自包括以下项或由以下项组成的组:c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;氟;氯;溴;碘;苯基和取代的苯基;其中,所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不
同的取代基取代:c
1-c6直链和支链烷基、烯基和炔基;和c
1-c6氟烷基、氯烷基、溴烷基和碘烷基(a7),
[0070]
等等。
[0071]
r’可以代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自包括以下项或由以下项组成的组:氟;氯;溴;碘;羟基;氰基;氨基;硝基;三氟甲基;c
1-c6直链和支链烷氧基;c
1-c6磺酰氧基;-s-c
1-c6烷基;c
1-c
12
直链和支链烷基、烯基和炔基;c
1-c6氟烷基、氯烷基、溴烷基和碘烷基;cooh;conh2;-nhco(c
1-c6烷基);coo-c
1-c6烷基;conh(c
1-c6烷基);和con(c
1-c6烷基)2。这种变体表示为c1。
[0072]
r’可以代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自包括以下项或由以下项组成的组:氟;氯;溴;碘;羟基;氰基;氨基;硝基;三氟甲基;cooh;-nhco(c
1-c6烷基)和conh2。这种变体表示为c2。
[0073]
r’可以代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自包括以下项或由以下项组成的组:羟基、甲氧基、氟、氯、溴和碘。这种变体表示为c3。
[0074]
优选地,r'代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自包括以下项或由以下项组成的组:羟基、甲氧基、碘、溴和氯。这种变体表示为c4。
[0075]
r'可以代表零个取代基,意指上面画有r'作为取代基的苯基环实际上是未取代的。r’可以代表一个取代基,诸如在2-位置,诸如在3-位置,诸如在4-位置。r’可以代表两个取代基,诸如在位置2和6,诸如在位置2和5,诸如在位置2和3,诸如在位置3和5,诸如在位置2和4,诸如在位置3和4。r’可以代表三个取代基,诸如在位置2、3和6,诸如在位置2、4和6,诸如在位置2、3和4,诸如在位置2、3和5,诸如在位置3、4和5。r’可以代表四个取代基,诸如在位置2、3、4和6,诸如在位置2、3、4和5,诸如在位置2、3、5和6。r’可以代表五个取代基。
[0076]
优选地,r’代表两个取代基,在位置3和4。
[0077]
在一些变体中,所述取代基中的两个彼此相同。在一些变体中,取代基中的三个彼此相同。在一些变体中,取代基中的四个彼此相同。在一些变体中,取代基中的五个彼此相同。在其他变体中,所述取代基全部彼此不同。
[0078]
在优选的变体中,r'代表两个取代基3-甲氧基和4-羟基。
[0079]
应当理解,本文公开的对可能的r基团、r'基团和苯基环上的取代基的各自选择解释为公开用于与本文公开的可能的r基团、r’基团以及苯基环上取代基的各自和每一个其他选择中的一个或多个任意组合。
[0080]
因此,在一些实施方式中,本发明提供了一般结构1和r和r'的capsaicyn的合成路线,如下所列出:
[0081]
a1+b1+c1、a1+b2+c1、a1+b3+c1、a1+b4+c1、a1+b5+c1、a2+b1+c1、a2+b2+c1、a2+b3+c1、a2+b4+c1、a2+b5+c1、a3+b1+c1、a3+b2+c1、a3+b3+c1、a3+b4+c1、a3+b5+c1、a4+b1+c1、a4+b2+c1、a4+b3+c1、a4+b4+c1、a4+b5+c1、a5+b1+c1、a5+b2+c1、a5+b3+c1、a5+b4+c1、a5+b5+c1、a6+b1+c1、a6+b2+c1、a6+b3+c1、a6+b4+c1、a6+b5+c1、a7+b1+c1、a7+b2+c1、a7+b3+c1、a7+b4+c1、a7+b5+c1、b6+c1、b7+c1、a1+b1+c2、a1+b2+c2、a1+b3+c2、a1+b4+c2、a1+b5+c2、a2+b1+c2、a2+b2+c2、a2+b3+c2、a2+b4+c2、a2+b5+c2、a3+b1+c2、a3+b2+c2、a3+b3+c2、a3+b4+c2、a3+b5+c2、a4+b1+c2、a4+b2+c2、a4+b3+c2、a4+b4+c2、a4+b5+c2、a5+b1+c2、a5+b2+c2、a5+b3+c2、a5+b4+c2、a5+b5+c2、a6+b1+c2、a6+b2+c2、a6+b3+c2、a6+b4+c2、a6+b5+c2、a7+b1+
c2、a7+b2+c2、a7+b3+c2、a7+b4+c2、a7+b5+c2,
[0082]
b6+c2、b7+c2、a1+b1+c3、a1+b2+c3、a1+b3+c3、a1+b4+c3、a1+b5+c3、a2+b1+c3、a2+b2+c3、a2+b3+c3、a2+b4+c3、a2+b5+c3、a3+b1+c3、a3+b2+c3、a3+b3+c3、a3+b4+c3、a3+b5+c3、a4+b1+c3、a4+b2+c3、a4+b3+c3、a4+b4+c3、a4+b5+c3、a5+b1+c3、a5+b2+c3、a5+b3+c3、a5+b4+c3、a5+b5+c3、a6+b1+c3、a6+b2+c3、a6+b3+c3、a6+b4+c3、a6+b5+c3,
[0083]
a7+b1+c3、a7+b2+c3、a7+b3+c3、a7+b4+c3、a7+b5+c3、b6+c3、b7+c3、a1+b1+c4、a1+b2+c4、a1+b3+c4、a1+b4+c4、a1+b5+c4、a2+b1+c4、a2+b2+c4、a2+b3+c4、a2+b4+c4、a2+b5+c4、a3+b1+c4、a3+b2+c4、a3+b3+c4、a3+b4+c4、a3+b5+c4、a4+b1+c4、a4+b2+c4、a4+b3+c4、a4+b4+c4、a4+b5+c4、a5+b1+c4、a5+b2+c4、a5+b3+c4、a5+b4+c4、a5+b5+c4,
[0084]
a6+b1+c4、a6+b2+c4、a6+b3+c4、a6+b4+c4、a6+b5+c4、a7+b1+c4、a7+b2+c4、a7+b3+c4、a7+b4+c4、a7+b5+c4、b6+c4、b7+c4。
[0085]
字母-数字组合是指上文限定的变体,使得例如
[0086]
a1+b1+c1表示一种化合物,其中r选自包括以下项或由以下项组成的组:氢、c
1-c
18
直链和支链烷基、烯基和炔基;三氟甲基;c
3-c
12
环烷基;苯氧基;苯硫基;氟;氯;溴;碘;苯基和取代的苯基(b1);其中,所述取代的苯基可以在任何一个或多个位置中被选自包括以下项或由以下项组成的组的1-5个相同或不同的取代基取代:氟;氯;溴;碘;氰基;硝基;三氟甲基;c
1-c6直链和支链烷氧基;c
1-c6磺酰氧基;-s-c
1-c6烷基;c
1-c
12
直链和支链烷基、烯基和炔基;c
1-c6氟烷基、氯烷基、溴烷基和碘烷基;coo-c
1-c6烷基;和con(c
1-c6烷基)2(a1);以及r’代表0-5个相同或不同的取代基,在任何一个或多个位置中,选自包括以下项或由以下项组成的组:氟;氯;溴;碘;羟基;氰基;氨基;硝基;三氟甲基;c
1-c6直链和支链烷氧基;c
1-c6磺酰氧基;-s-c
1-c6烷基;c
1-c
12
直链和支链烷基、烯基和炔基;c
1-c6氟烷基、氯烷基、溴烷基和碘烷基;cooh;conh2;-nhco(c
1-c6烷基);coo-c
1-c6烷基;conh(c
1-c6烷基);和con(c
1-c6烷基)2(c1)等等。
[0087]
在优选的实施方式中,本发明提供了一般结构1和r和r'的capsaicyn的合成路线,如下所列出:
[0088]
a1+b1+c1、a1+b2+c1、a1+b3+c1、a1+b4+c1、a1+b5+c1、a2+b1+c1、a2+b2+c1、a2+b3+c1、a2+b4+c1、a2+b5+c1、a3+b1+c1、a3+b2+c1、a3+b3+c1、a3+b4+c1、a3+b5+c1、a4+b1+c1、a4+b2+c1、a4+b3+c1、a4+b4+c1、a4+b5+c1、a5+b1+c1、a5+b2+c1、a5+b3+c1、a5+b4+c1、a5+b5+c1、a6+b1+c1、a6+b2+c1、a6+b3+c1、a6+b4+c1、a6+b5+c1、a7+b1+c1、a7+b2+c1、a7+b3+c1、a7+b4+c1、a7+b5+c1、b6+c1、b7+c1、a1+b1+c2、a1+b2+c2、a1+b3+c2、a1+b4+c2、a1+b5+c2、a2+b1+c2、a2+b2+c2、a2+b3+c2、a2+b4+c2、a2+b5+c2、a3+b1+c2、a3+b2+c2、a3+b3+c2、a3+b4+c2、a3+b5+c2、a4+b1+c2、a4+b2+c2、a4+b3+c2、a4+b4+c2、a4+b5+c2、a5+b1+c2、a5+b2+c2、a5+b3+c2、a5+b4+c2、a5+b5+c2、a6+b1+c2、a6+b2+c2、a6+b3+c2、a6+b4+c2、a6+b5+c2、a7+b1+c2、a7+b2+c2、a7+b3+c2、a7+b4+c2、a7+b5+c2,
[0089]
b6+c2、b7+c2、a1+b1+c3、a1+b2+c3、a1+b3+c3、a1+b4+c3、a1+b5+c3、a2+b1+c3、a2+b2+c3、a2+b3+c3、a2+b4+c3、a2+b5+c3、a3+b1+c3、a3+b2+c3、a3+b3+c3、a3+b4+c3、a3+b5+c3、a4+b1+c3、a4+b2+c3、a4+b3+c3、a4+b4+c3、a4+b5+c3、a5+b1+c3、a5+b2+c3、a5+b3+c3、a5+b4+c3、a5+b5+c3、a6+b1+c3、a6+b2+c3、a6+b3+c3、a6+b4+c3、a6+b5+c3,
[0090]
a7+b1+c3、a7+b2+c3、a7+b3+c3、a7+b4+c3、a7+b5+c3、b6+c3、b7+c3、a1+b1+c4、a1+
b2+c4、a1+b3+c4、a1+b4+c4、a1+b5+c4、a2+b1+c4、a2+b2+c4、a2+b3+c4、a2+b4+c4、a2+b5+c4、a3+b1+c4、a3+b2+c4、a3+b3+c4、a3+b4+c4、a3+b5+c4、a4+b1+c4、a4+b2+c4、a4+b3+c4、a4+b4+c4、a4+b5+c4、a5+b1+c4、a5+b2+c4、a5+b3+c4、a5+b4+c4、a5+b5+c4,
[0091]
a6+b1+c4、a6+b2+c4、a6+b3+c4、a6+b4+c4、a6+b5+c4、a7+b1+c4、a7+b2+c4、a7+b3+c4、a7+b4+c4、a7+b5+c4、b6+c4、b7+c4,
[0092]
其中,r'代表两个取代基,在位置3和4,优选地r'代表两个取代基3-甲氧基和4-羟基。
[0093]
在优选的实施方式中,本发明提供了一般结构1和r和r'的capsaicyn的合成路线,如下所列出:
[0094]
a1+b1+c1、a1+b2+c1、a1+b3+c1、a1+b4+c1、a1+b5+c1、a2+b1+c1、a2+b2+c1、a2+b3+c1、a2+b4+c1、a2+b5+c1、a3+b1+c1、a3+b2+c1、a3+b3+c1、a3+b4+c1、a3+b5+c1、a4+b1+c1、a4+b2+c1、a4+b3+c1、a4+b4+c1、a4+b5+c1、a5+b1+c1、a5+b2+c1、a5+b3+c1、a5+b4+c1、a5+b5+c1、a6+b1+c1、a6+b2+c1、a6+b3+c1、a6+b4+c1、a6+b5+c1、a7+b1+c1、a7+b2+c1、a7+b3+c1、a7+b4+c1、a7+b5+c1、b6+c1、b7+c1、a1+b1+c2、a1+b2+c2、a1+b3+c2、a1+b4+c2、a1+b5+c2、a2+b1+c2、a2+b2+c2、a2+b3+c2、a2+b4+c2、a2+b5+c2、a3+b1+c2、a3+b2+c2、a3+b3+c2、a3+b4+c2、a3+b5+c2、a4+b1+c2、a4+b2+c2、a4+b3+c2、a4+b4+c2、a4+b5+c2、a5+b1+c2、a5+b2+c2、a5+b3+c2、a5+b4+c2、a5+b5+c2、a6+b1+c2、a6+b2+c2、a6+b3+c2、a6+b4+c2、a6+b5+c2、a7+b1+c2、a7+b2+c2、a7+b3+c2、a7+b4+c2、a7+b5+c2,
[0095]
b6+c2、b7+c2、a1+b1+c3、a1+b2+c3、a1+b3+c3、a1+b4+c3、a1+b5+c3、a2+b1+c3、a2+b2+c3、a2+b3+c3、a2+b4+c3、a2+b5+c3、a3+b1+c3、a3+b2+c3、a3+b3+c3、a3+b4+c3、a3+b5+c3、a4+b1+c3、a4+b2+c3、a4+b3+c3、a4+b4+c3、a4+b5+c3、a5+b1+c3、a5+b2+c3、a5+b3+c3、a5+b4+c3、a5+b5+c3、a6+b1+c3、a6+b2+c3、a6+b3+c3、a6+b4+c3、a6+b5+c3,
[0096]
a7+b1+c3、a7+b2+c3、a7+b3+c3、a7+b4+c3、a7+b5+c3、b6+c3、b7+c3、a1+b1+c4、a1+b2+c4、a1+b3+c4、a1+b4+c4、a1+b5+c4、a2+b1+c4、a2+b2+c4、a2+b3+c4、a2+b4+c4、a2+b5+c4、a3+b1+c4、a3+b2+c4、a3+b3+c4、a3+b4+c4、a3+b5+c4、a4+b1+c4、a4+b2+c4、a4+b3+c4、a4+b4+c4、a4+b5+c4、a5+b1+c4、a5+b2+c4、a5+b3+c4、a5+b4+c4、a5+b5+c4,
[0097]
a6+b1+c4、a6+b2+c4、a6+b3+c4、a6+b4+c4、a6+b5+c4、a7+b1+c4、a7+b2+c4、a7+b3+c4、a7+b4+c4、a7+b5+c4、b6+c4、b7+c4,
[0098]
每个字母-数字组合是指由上文列出的取代基组成的变体,其中,r'代表两个取代基,在位置3和4,优选地r'代表两个取代基3-甲氧基和4-羟基。
[0099]
在其他优选的实施方式中,本发明提供了一般结构1和r和r'的苯基辣椒素类的合成路线,如下所列出:
[0100]
b7+c1、b7+c2、b7+c3、b7+c4,
[0101]
优选地,其中r'代表两个取代基,在位置3和4,更优选地,r'代表两个取代基3-甲氧基和4-羟基。
[0102]
在进一步优选的实施方式中,本发明提供了一般结构1和r和r'的苯基辣椒素类的合成路线,如下所列出:
[0103]
b7+c1、b7+c2、b7+c3、b7+c4,
[0104]
每个字母-数字组合是指由上文列出的取代基组成的变体,优选地,其中r'代表两
个取代基,在位置3和4,更优选地,r'代表两个取代基3-甲氧基和4-羟基。
[0105]
可以根据本发明合成的辣椒素衍生物的非限制性实例包括
[0106]
n-[(4-羟基-3-甲氧基苯基)甲基]-7-苯基-6-庚炔酰胺(苯基辣椒素,1a)
[0107]
n-苄基-7-苯基-6-庚炔酰胺
[0108]
n-[(4-羟基-3-甲氧基苯基)甲基]-7-环己基-6-庚炔酰胺(1c)
[0109]
n-[(4-羟基-3-甲氧基苯基)甲基]-10-乙基-6-十二炔酰胺
[0110]
n-[(4-羟基-3-甲氧基苯基)甲基]-8,8,8-三氟-6-辛炔酰胺
[0111]
n-(3-己基苯基)甲基-7-苯基-6-庚炔酰胺n-[(4-羟基-3-甲氧基苯基)甲基]-7-(3,5-二乙氧基苯基)-6-庚炔酰胺
[0112]
n-[(4-羟基-3-甲氧基苯基)甲基]-6-辛炔酰胺
[0113]
n-[(4-羟基-3-甲氧基苯基)甲基]-6-壬炔酰胺
[0114]
n-[(4-羟基-3-甲氧基苯基)甲基]-8-甲基-6-壬炔酰胺
[0115]
n-[(4-羟基-3-甲氧基苯基)甲基]-8,8-二甲基-6-壬炔酰胺(1b)
[0116]
n-(3,4-二溴苯基)甲基-7-苯基-6-庚炔酰胺
[0117]
n-[(3-乙基-2-异丙基-6-甲基苯基)甲基]-7-(2,6-二甲苯基)-6-庚炔酰胺
[0118]
n-(3,5-二乙氧基苯基)甲基-7-(对氟苯基)-6-庚炔酰胺
[0119]
n-[(4-羟基-3-甲氧基苯基)甲基]-7-溴-6-庚炔酰胺
[0120]
n-[(4-羟基-3-甲氧基苯基)甲基]-7-环戊基-6-庚炔酰胺
[0121]
在一些实施方式中,本发明提供了辣椒素的苯基取代的6-炔衍生物(通常称为苯基辣椒素类)的合成路线,其中,r是苯基或取代的苯基并且r'代表两个取代基3-甲氧基和4-羟基。
[0122]
在一种特定的实施方式中,本发明提供了苯基辣椒素的合成路线,其中r是苯基并且r'代表两个取代基3-甲氧基和4-羟基。
[0123]
步骤3
[0124]
在所有实施方式中,辣椒素衍生物1由前体3和苄胺2合成。此步骤称为步骤3。在温和条件下用1,1'-羰基二咪唑(cdi)处理得到产物1。该反应是使用由lafrance等人[lafrance et al.,org.lett.2011,13(9),2322]首先提出的方法进行的,并且被认为是经由羰基咪唑中间体进行的。步骤3在方案4中示出。
[0125]
在合成路线的开发期间,发明人发现二酸3的脱羧随后转化为相应的酰基氯以与2偶联是令人惊讶的挑战。这种可能的脱羧/偶联路线,更类似于先前报道的依赖亚硫酰氯的路线,具有脱羧需要高温并且最好以纯净进行的缺点,因此限制了反应范围。本发明通过直接利用二酸3的优异cdi偶联解决了这个问题,并且避免了对单独的脱羧步骤的需要。
[0126][0127]
方案4
[0128]
步骤3中使用的反应物可以以技术人员已知的任何方式获得,诸如从天然来源获得,诸如商业获取,诸如使用任何路线和起始材料合成。
[0129]
苄胺可以是游离胺或呈任何合适的盐诸如盐酸盐的形式。
[0130]
在优选的实施方式中,苄胺(2)是香兰素胺盐酸盐(2a)。
[0131][0132]
通过将化合物3添加至cdi以形成推测的羰基咪唑中间体来进行步骤3。在一些实施方式中,3的添加是渐进的,诸如逐滴。在可以使用的技术人员理解为适合用于反应的任何溶剂或者两种或更多种溶剂的组合中进行反应。在一些实施方式中,溶剂选自包括但不限于以下项的列表:甲基叔丁基醚(mtbe)、四氢呋喃(thf)、二氯甲烷、乙腈、甲苯、乙酸乙酯、二甲基甲酰胺(dmf)或其任何组合。在某些实施方式中,溶剂是mtbe。溶剂可以是无水溶剂。
[0133]
在一些实施方式中,在环境温度下进行方案4的反应。在其他实施方式中,在升高的温度,诸如25℃和溶剂的沸点之间、诸如25℃和110℃之间、诸如25℃和75℃之间、诸如30℃和50℃之间、诸如在40℃下进行反应。在一些实施方式中,在贯穿反应的过程中保持相同的反应温度。在其他实施方式中,反应温度在反应过程期间变化和/或允许变化。在某些实施方式中,在环境温度下一段时间后加热反应混合物诸如至25℃和110℃之间、诸如至25℃和75℃之间、诸如至30℃和50℃之间、诸如至40℃。
[0134]
在一些实施方式中,在添加化合物2或加入至化合物2之前的反应时间是基于反应混合物的分析何时示出反应已进行至完成,或反应混合物的分析何时示出反应已经停止来确定的。可以使用技术人员已知的任何分析方法,诸如色谱方法、诸如薄层色谱法、诸如hplc。在其他实施方式中,使用设定的反应时间。在一些实施方式中,反应时间为15分钟和3小时之间,诸如30分钟和2小时之间,诸如1小时和1小时45分钟之间。
[0135]
将化合物2添加至包括化合物3和cdi的反应混合物中,或者将包括化合物3和cdi的反应混合物添加至化合物2中。在一些实施方式中,使用等摩尔量的2和3。在其他实施方式中,基于3的量,使用过量的2,诸如1.01-1.5摩尔当量、诸如1.05-1.4摩尔当量、诸如1.1-1.3当量。在又其他实施方式中,基于2的量,使用过量的3,诸如1.01-1.5摩尔当量、诸如1.05-1.4摩尔当量、诸如1.1-1.3当量。
[0136]
在一些实施方式中,3和2之间的反应在环境温度下进行。在其他实施方式中,在升高的温度,诸如25℃和溶剂的沸点之间、诸如25℃和110℃之间、诸如25℃和75℃之间、诸如30℃和50℃之间、诸如在45℃下进行反应。在一些实施方式中,在贯穿反应的过程中保持相同的反应温度。在其他实施方式中,反应温度在反应过程期间变化和/或允许变化。
[0137]
在一些实施方式中,将反应混合物淬灭,诸如通过添加水,诸如在添加水之后在升高的温度下持续搅拌。可以通过本领域技术人员通常使用的任何方法进行反应混合物的后处理。在一些实施方式中,发生相分离。在某些实施方式中,期望的产物(1)在有机相中,并通过本领域技术人员通常使用的方法从该有机相中沉淀出来。
[0138]
在一些实施方式中,当反应混合物的分析示出反应已进行至完成时,或当反应混合物的分析示出反应已经停止时,淬灭反应混合物。可以使用技术人员已知的任何分析方法,诸如色谱方法、诸如薄层色谱法、诸如hplc。在其他实施方式中,在设定的反应时间,诸
如2-50小时、诸如5-40小时、诸如10-25小时、诸如15-20小时、诸如15-30小时之后淬灭反应混合物。
[0139]
在步骤3的优选实施方式中,通过将化合物3逐滴添加至cdi中,并使用mtbe作为溶剂且反应温度在25℃和50℃之间来进行步骤3。化合物2可以是香兰素胺,优选香兰素胺盐酸盐(2a)。
[0140]
步骤2
[0141]
在一些实施方式中,化合物3通过使化合物4与丙二酸二烷基酯(5)在碱性条件下反应合成,诸如经由中间体3',如方案5中示出。此步骤称为步骤2。
[0142][0143]
方案5
[0144]
方案5中的alk表示直链、支链或环状c
1-c6烷基基团,因此化合物5是丙二酸二烷基酯。在一些实施方式中,alk基团彼此相同。在一些实施方式中,两个alk基团都是甲基,因此5是丙二酸二甲酯。在一些实施方式中,两个alk基团都是乙基,因此5是丙二酸二乙酯。
[0145]
步骤2中使用的反应物可以以技术人员已知的任何方式获得,诸如从天然来源获得,诸如商业获取,诸如使用任何路线和起始材料合成。
[0146]
方案5中的lg表示本领域技术人员熟知的任何离去基团。在一些实施方式中,lg选自包括但不限于以下项的列表:全氟烷基磺酸酯基诸如三氟甲磺酸酯基;磺酸酯基诸如甲苯磺酸酯基、甲磺酸酯基;以及氟;氯;溴和碘。在一些实施方式中,lg选自氟、氯、溴、碘、三氟甲磺酸酯基、甲苯磺酸酯基和甲磺酸酯基。在一些实施方式中,lg是氯。
[0147]
可以使用技术人员通常用于丙二酸二烷基酯的去质子化的任何碱来进行化合物4和丙二酸二烷基酯5之间的步骤2的反应。在一些实施方式中,碱选自包括但不限于以下项的列表:醇盐碱,诸如甲醇钠、乙醇钠、丁醇钠,诸如在乙醇中的乙醇钠,诸如在甲醇中的甲醇钠;以及氢氧化物碱,诸如氢氧化钠。在一些实施方式中,在添加化合物4之前用碱预处理化合物5,而在其他实施方式中,同时添加化合物5、碱和化合物4。在一些实施方式中,使用等摩尔量的5和4。在其他实施方式中,基于5的量,使用过量的4,诸如1.01-1.5摩尔当量、诸如1.05-1.4摩尔当量、诸如1.1-1.3摩尔当量。在又其他实施方式中,基于4的量,使用过量的5,诸如1.01-1.5摩尔当量、诸如1.05-1.4摩尔当量、诸如1.1-1.3摩尔当量。
[0148]
可以使用技术人员理解为适合用于反应的任何溶剂或者两种或更多种溶剂的组合。在一些实施方式中,溶剂选自包括但不限于以下项的列表:甲醇、乙醇、正丙醇、异丙醇、叔丁醇、dmso、dmf、thf、mtbe、甲苯或其任何组合。在某些实施方式中,溶剂是甲醇。在某些实施方式中,溶剂是乙醇。溶剂可以是无水溶剂。
[0149]
在一些实施方式中,4和5之间的反应在环境温度下进行。在其他实施方式中,在升高的温度,诸如25℃和溶剂的沸点之间、诸如25℃和78℃之间、诸如40℃和75℃之间、诸如60℃和75℃之间、诸如在70℃下进行反应。在一些实施方式中,在贯穿反应的过程中保持相同的反应温度。在其他实施方式中,反应温度在反应过程期间变化和/或允许变化。在一些实施方式中,当反应混合物的分析示出反应已进行至完成时,或当反应混合物的分析示出
反应已经停止时,淬灭反应混合物。可以使用技术人员已知的任何分析方法,诸如色谱方法、诸如薄层色谱法、诸如hplc。在其他实施方式中,在设定的反应时间,诸如10-70小时、诸如20-60小时、诸如30-50小时、诸如40-50小时之后淬灭反应混合物。在一些实施方式中,将反应混合物淬灭,诸如在环境温度下,诸如通过添加水。
[0150]
然后将所得的二酯中间体3'转化为相应的二酸化合物3。
[0151]
在一些实施方式中,在所述转化之前,使用本领域技术人员已知的标准技术来分离中间体3'。在优选的实施方式中,中间体3'未进行分离。
[0152]
在一些实施方式中,所述转化通过向化合物3'添加碱,诸如通过添加水性碱来实现。在一些实施方式中,碱选自包括但不限于以下项的列表:氢氧化钠、氢氧化锂、氢氧化钾、氢氧化铷、氢氧化铯、氢氧化钙、氢氧化锶、氢氧化钡。在某些实施方式中,碱是氢氧化钠。在一些实施方式中,允许试剂反应直到反应混合物的分析示出反应已进行至完成,或当反应混合物的分析示出反应已经停止时。可以使用技术人员已知的任何分析方法,诸如色谱方法、诸如薄层色谱法、诸如hplc。在其他实施方式中,在设定的反应时间之后淬灭反应混合物。
[0153]
可以通过本领域技术人员通常使用的任何方法,诸如通过真空下浓缩和重新溶解,诸如重新溶解在水中,来进行反应混合物的后处理。在一些实施方式中,提取混合物,诸如在浓缩和重新溶解于水中之后。在一些实施方式中,将所得水相添加酸的水溶液,诸如hcl,直到产物沉淀。在其他实施方式中,将水相酸化并且将产物萃取到有机相中。在一些实施方式中,洗涤产物。可以过滤并冲洗固体产物。
[0154]
在步骤2的优选实施方式中,步骤2使用丙二酸二乙酯或丙二酸二甲酯和醇盐碱进行,并且二酯中间体3'在用氢氧化钠水溶液处理以产生3之前未进行分离。lg可以是氯。
[0155]
步骤1
[0156]
在一些实施方式中,通过用碱处理化合物7并将其与通式lg-ch
2-ch
2-ch
2-lg’(6)的1,3-取代的丙烷化合物反应来合成化合物4,如方案6中示出,其中lg和lg'是技术人员已知的离去基团。此步骤称为步骤1。在优选的实施方式中,lg和lg'是具有不同离去基团能力的不同离去基团。在其他实施方式中,lg和lg'是相同的。
[0157][0158]
方案6
[0159]
步骤1中使用的反应物可以以技术人员已知的任何方式获得,诸如从天然来源获得,诸如商业获取,诸如使用任何路线和起始材料合成。
[0160]
在一些实施方式中,lg和lg’是不同或相同的离去基团,选自包括但不限于以下项的列表:全氟烷基磺酸酯基诸如三氟甲磺酸酯基;磺酸酯基诸如甲苯磺酸酯基、甲磺酸酯基;氟、氯、溴和碘。在一些实施方式中,lg和lg’选自氟、氯、溴、碘、三氟甲磺酸酯基、甲苯磺酸酯基和甲磺酸酯基。在一些实施方式中,lg和lg’两者均选自氯、溴和碘。在优选的实施方式中,lg和lg'分别是氯和溴,并且因此6是1-溴-3-氯丙烷。
[0161]
在一些实施方式中,碱选自包括但不限于以下项的列表:氢化钠(nah)、正丁基锂(n-buli)、叔丁基锂(t-buli)、二异丙基氨基锂(lda)、氨基钠(nanh2)、双(三甲基硅烷基)
氨基锂(((ch3)3si)2nli)。在一些实施方式中,碱是氢化钠,诸如矿物油中的氢化钠。在一些实施方式中,在添加化合物6之前用碱预处理化合物7,而在其他实施方式中,同时添加化合物7、碱和化合物6。在一些实施方式中,使用等摩尔量的7、碱和6。在其他实施方式中,基于7的量,使用过量的碱,诸如1.01-1.5摩尔当量、诸如1.1-1.4摩尔当量、诸如1.2-1.35摩尔当量。在某些实施方式中,基于7的量,使用过量的6,诸如1.01-1.8摩尔当量、诸如1.2-1.7摩尔当量、诸如1.4-1.6摩尔当量。
[0162]
在一些实施方式中,使用无水条件,特别是在技术人员将认识到需要这样或这样的优点的实施方式中。
[0163]
可以使用技术人员理解为适合用于反应的任何溶剂或者两种或更多种溶剂的组合。在一些实施方式中,溶剂选自包括但不限于以下项的列表:thf、二氯甲烷、n-甲基吡咯烷酮、mtbe、二噁烷、2-methf、环戊基甲基醚、dmso、dmf或其任何组合。在某些实施方式中,溶剂包含dmso。在某些实施方式中,溶剂是dmso。在某些实施方式中,溶剂是thf和dmso的任何混合物。溶剂可以是无水溶剂。
[0164]
在一些实施方式中,在环境温度下进行反应。在其他实施方式中,在低于环境温度的温度,诸如在-78℃和-20℃之间进行反应。在其他实施方式中,在升高的温度,诸如25℃和溶剂的沸点之间、诸如25℃和65℃之间、诸如30℃和60℃之间、诸如40℃和55℃之间、诸如在50℃下进行反应。在一些实施方式中,在贯穿反应的过程中保持相同的反应温度。在其他实施方式中,反应温度在反应过程期间变化和/或允许变化。在一些实施方式中,当反应混合物的分析示出反应已进行至完成时,或当反应混合物的分析示出反应已经停止时,淬灭反应混合物。可以使用技术人员已知的任何分析方法,诸如色谱方法、诸如薄层色谱法、诸如hplc、诸如gc。在其他实施方式中,在设定的反应时间,诸如2-50小时、诸如5-40小时、诸如10-25小时、诸如15-20小时、诸如15-30小时之后淬灭反应混合物。
[0165]
在一些实施方式中,将反应混合物淬灭,诸如在环境温度下,诸如通过添加酸,诸如通过添加水,诸如通过添加强酸的水溶液,诸如通过添加弱酸的水溶液。在一些实施方式中,通过添加选自包括但不限于以下项的列表的酸的水溶液来淬灭反应:盐酸、硝酸、硫酸、氢溴酸、氢碘酸、高氯酸和氯酸。
[0166]
可以通过本领域技术人员通常使用的任何方法,诸如通过在用酸的水溶液淬灭之后分离两层和/或通过萃取有机相来进行反应混合物的后处理。在一些实施方式中,蒸发来自有机相的溶剂以产生粗产物。在一些实施方式中,将有机相或粗产物纯化,诸如通过本领域技术人员通常使用的任何方法。在一些实施方式中,纯化方法是蒸馏。在某些实施方式中,纯化方法是在在减压,诸如在0.1-50mmhg、诸如在30-50mmhg、诸如在30-40mmhg、诸如在10-40mmhg、诸如在0.1-20mmhg、诸如在1-10mmhg、诸如在2-3mmhg下蒸馏。
[0167]
在步骤1的优选实施方式中,lg和lg’两者均为卤素,碱为氢化钠,以及溶剂包含dmso。lg和lg’可以分别是氯和溴。
[0168]
在一些实施方式中,使用以技术人员已知的任何方式获得的,诸如从天然来源获得的,诸如商业获取的,诸如使用任何路线和起始材料合成的反应物(3和2),使用步骤3来合成化合物1。优选地,通过将化合物3逐滴添加至cdi中,并使用mtbe作为溶剂且反应温度在25℃和50℃之间,并且随后添加苄胺2来进行步骤3。
[0169]
在其他实施方式中,使用以技术人员已知的任何方式获得的,诸如从天然来源获
得的,诸如商业获取的,诸如使用任何路线和起始材料合成的反应物(4和5),如方案7中所示,使用步骤2和3来合成化合物1。优选地,步骤2使用丙二酸二乙酯或丙二酸二甲酯和醇盐碱进行,并且二酯中间体3'在用氢氧化钠水溶液处理以产生3之前未进行分离,以及步骤3通过将化合物3逐滴添加至cdi中,使用mtbe作为溶剂且反应温度在25℃和50℃之间,并且随后添加苄胺2来进行。
[0170][0171]
方案7
[0172]
在又其他实施方式中,化合物1是使用步骤1、2和3合成的,如方案8中所示。优选地,在步骤1中,lg和lg’两者均为卤素,碱为氢化钠,以及溶剂包含dmso和thf;步骤2使用丙二酸二乙酯或丙二酸二甲酯和醇盐碱进行,并且二酯中间体3’在用氢氧化钠处理以产生3之前未进行分离;以及步骤3通过将化合物3逐滴添加至cdi中,并使用mtbe作为溶剂且反应温度在25℃和50℃之间,并且随后添加苄胺2来进行。
[0173][0174]
方案8
[0175]
在一些实施方式中,本发明提供了一般结构1v的具有完整香草基环的capsaicyn的合成路线,如方案9中示出。在这样的实施方式中,化合物2是香兰素胺,诸如香兰素胺盐酸盐(2a)。在某些实施方式中,仅进行步骤3。在其他实施方式中,进行步骤2和3。在又其他实施方式中,进行所有步骤1-3。
[0176]
优选地,在步骤1(如果进行)中,lg和lg’两者均为卤素,碱为氢化钠,以及溶剂包含dmso和thf;步骤2(如果进行)使用丙二酸二乙酯或丙二酸二甲酯和醇盐碱进行,并且二酯中间体3’在用氢氧化钠水溶液处理以产生3之前未进行分离;以及步骤3通过将化合物3逐滴添加至cdi中,并使用mtbe作为溶剂且反应温度在25℃和50℃之间,并且随后添加苄胺2来进行。
[0177][0178]
方案9
[0179]
在一些实施方式中,本发明提供了一般结构1p的苯基capsaicyn的合成路线,如方案10中示出。在这样的实施方式中,化合物2是香兰素胺,诸如香兰素胺盐酸盐(2a),并且取代基ar是如上所述的苯基环或取代的苯基环。在某些实施方式中,仅进行步骤3。在其他实施方式中,进行步骤2和3。在又其他实施方式中,进行步骤1-3。优选地,在步骤1(如果进行)中,lg和lg’两者均为卤素,碱为氢化钠,以及溶剂包含dmso和thf;步骤2(如果进行)使用丙二酸二乙酯或丙二酸二甲酯和醇盐碱进行,并且二酯中间体3’在用氢氧化钠处理以产生3之前未进行分离;以及步骤3通过将化合物3逐滴添加至cdi中,并使用mtbe作为溶剂且反应温度在25℃和50℃之间,并且随后添加苄胺2来进行。
[0180][0181]
方案10
[0182]
在特定实施方式中,本发明提供了苯基辣椒素(1a)的合成路线,如方案11中示出。在这样的实施方式中,化合物2是香兰素胺盐酸盐,2a,取代基ph是未取代的苯基环。在某些实施方式中,仅进行步骤3。在其他实施方式中,进行步骤2和3。在又其他实施方式中,进行步骤1-3。
[0183]
优选地,在步骤1(如果进行)中,lg和lg’两者均为卤素,碱为氢化钠,以及溶剂包含dmso和thf;步骤2(如果进行)使用丙二酸二乙酯或丙二酸二甲酯和醇盐碱进行,并且二酯中间体3’在用氢氧化钠处理以产生3之前未进行分离;以及步骤3通过将化合物3逐滴添加至cdi中,并使用mtbe作为溶剂且反应温度在25℃和50℃之间,并且随后添加苄胺2来进行。
[0184][0185]
方案11
[0186]
结晶
[0187]
根据本发明合成的所有辣椒素衍生物可以在它们合成之后进行纯化。在一些实施方式中,辣椒素衍生物是固体化合物。对于这样的实施方式,辣椒素衍生物可以是结晶的。在一些实施方式中,苯基辣椒素(1a)通过将水添加至1a在mtbe中的溶液,诸如直接从步骤3得到的1a的溶液中来结晶,任选地在用水洗涤有机相之后。溶液的浓度可以是0.05-1g/ml,诸如0.05-0.5g/ml、诸如1-0.4g/ml、诸如0.5-1g/ml、诸如0.7-0.9g/ml。结晶通过以下进行:添加每体积溶剂0.25-1体积的水,诸如每体积溶剂0.3-0.8、诸如0.4-0.7体积的水,并在冷却下搅拌至温度在-5℃至5℃范围中2-24小时,诸如过夜、诸如3-6小时、诸如5小时,以得到1a的晶体。可以分离晶体,诸如通过过滤,以及任选地用mtbe冲洗并干燥,诸如风干。
[0188]
在特定的实施方式中,通过以下结晶1a:在用水洗涤有机相之后,将水添加至直接从步骤3得到的1a的溶液中,通过添加水并在冷却下搅拌至温度在-5℃至5℃范围5小时。
[0189]
技术人员将清楚,针对1a描述的结晶方法或类似方法也可用于其他辣椒素衍生物。
[0190]
本发明不应限于示出的实施方式和实例。尽管本文描述了本公开的各种实施方式,但是对于本领域技术人员来说显而易见的是这样的实施方式仅以示例的方式提供。在不脱离本发明的范围的情况下,本文描述的实施方式的许多修改和改变以及变化和替换对于本领域技术人员来说将是显而易见的。应当理解,在实施本公开中可以采用对本文描述的实施方式的各种替代。此外,预期所附权利要求将涵盖落入本发明真实范围内的此类修改和变化。
[0191]
应当理解,本公开的每种实施方式可以任选地与本文描述的其他实施方式中的任何一个或多个组合。
[0192]
应当理解,本文公开的每种组分、化合物或参数应解释为被公开用于单独使用或与本文公开的所有其他组分、化合物或参数中的一个或多个组合使用。还应当理解,为了本说明书的目的,本文公开的每种组分、化合物或参数的各自量/值或量/值范围应解释为也与本文公开的任何其他组分、混合物或参数的量/值或量/值范围组合公开,并且本文公开的两种或多种组分、化合物或参数的量/值或量/值范围的任意组合也因此彼此组合公开。本文描述的任何特征和所有特征,以及这些特征的组合都包括在本发明的范围内,只要这些特征不相互矛盾。
[0193]
应当理解,本文公开的每个范围的各自下限将被解释与本文公开的相同组分、化合物或参数的每个范围的各自上限组合公开。因此,两个范围的公开应被解释为通过将每个范围的各自下限与每个范围的各自上限组合得出的四个范围的公开。三个范围的公开应被解释为通过将每个范围的各自下限与每个范围的各自上限组合得到的九个范围的公开,等等。此外,在本说明书或实例中公开的组分、化合物或参数的特定量/值应被解释为对范围的下限或上限的公开,并且因此可以与本技术中其他地方公开的相同组分、化合物或参数的任何其他下限或上限或范围或特定量/值组合,以形成该组分、化合物或参数的范围。
[0194]
实施例
[0195]
根据方案12中示出的路线合成苯基辣椒素(1a)。通过hplc监测反应,在反相(phenomenex苯基-c6)柱上,用在ph 2下的80%甲醇(0.1%tfa)作为流动相,1.5ml/min,在240nm处分析。通过ms和/或nmr分析来鉴定产物。
[0196][0197]
方案12
[0198]
实施例1,(5-氯戊-1-炔-1-基)苯(4a)的制备(步骤1)
[0199]
将氢化钠(60%在矿物油中)(50g,1.25mol)悬浮在thf(960ml)中,并添加苯乙炔(7a)(98g,0.96mol)和dmso(150g,1.92mol),随后添加1-溴-3-氯丙烷(6a)(227g,1,44mmol),并在50℃下将所得混合物加热20小时。反应后,将混合物冷却并用500ml 0.5m hcl(水溶液)淬灭,随后暂停搅拌并将两层分离。将260ml庚烷添加至有机相,并用350ml水萃取所得混合物。蒸发所得有机相中的溶剂,产生266g的粗产物。粗产物通过在减压(2-3mmhg)下蒸馏来纯化,并分离出在30-40℃下沸腾的包含过量起始原料的第一馏分。在90-100℃下沸腾的主要馏分包含产物和少量化合物4a-1,其具有的沸点略低于3。因此很难将它去除,但由于它在随后步骤中不反应并在水解后完全去除,因此可以容许它的存在。蒸馏后4a的产率为146g(85%),包含1.5%的4a-1(通过hplc面积)。
[0200]1h nmr(dmso-d6)δ7.43-7.38(m,2h),7.35-7.32(m,3h),3.76(t,2h,j=6.4hz),
2.58(t,2h,j=7.0hz),1.98(p,2h,j=6.7hz);
13
c nmr(cdcl3)δ131.2,128.4,127.9,123.0,88.7,81.1,44.1,31.0,16,2。
[0201]
实施例2,2-(5-苯基戊-4-炔-1-基)丙二酸(3a)的制备(步骤2)
[0202]
化合物3a是经由中间体3'a(方案13中示出,只有乙基基团,但由于酯交换,其包含乙基和甲基基团的组合)合成的,其未进行分离。
[0203]
将丙二酸二乙酯(5a)(184g,1.15mol)和4a(137g,0.767mol)溶解在乙醇(430ml)中,随之添加甲醇钠(203g 25%溶液于甲醇中,0.939mol)。在70℃下加热混合物48小时。冷却后,用290ml水淬灭混合物,并添加333g的28%(水溶液)氢氧化钠溶液,并在30℃下搅拌反应混合物,直到hplc分析示出酯完全转化为丙二酸衍生物3a。
[0204]
将反应混合物在真空下浓缩成半结晶物质并重新溶解在550ml水中。用300ml份的甲基叔丁基醚萃取混合物两次。向所得水相中缓慢添加365g30%hcl,随之沉淀产物。在25℃下搅拌2小时后,过滤产物,用70ml的庚烷冲洗,随后用70ml的水冲洗。将所得产物3a风干以产生164g浅棕褐色晶体(87%产率)。
[0205]1h nmr(dmso-d6)δ7.38-7.34(m,2h),7.33-7.28(m,3h),3.31(t,1h,j=7.6hz),2.43(t,2h,j=6.9hz),1.90-1.84(m,2h),1.59-1.51(m,2h);
13
c nmr(dmso-d6)δ171.1,131.4,128.7,128.1,123.4,90.3,81.0,51.4,28.0,26.3,18.7。c
14h15o4+
[m+h]
+
的hrms(esi)计算值为247.0970,实测值为247.0968。
[0206]
实施例3,苯基辣椒素(1a)的制备(步骤3)
[0207]
将丙二酸3a(130g,0.528mol)溶解在375ml mtbe中并在气体析出下逐滴添加至羰基二咪唑(103g,0.635mol)在375ml mtbe中的悬浮液中,并将所得混合物在25℃下搅拌30分钟,并最后加热至40℃一小时以驱动反应完成。向混合物中添加香兰素胺盐酸盐(2a)(120g,0.633mol)并在45℃下继续搅拌20小时,随之添加500ml水并在40℃下搅拌混合物直到形成两个透明相。分离底部水性层,并在40℃下用500ml水再次萃取有机相。分离后添加300ml水,随后添加15ml hcl(30%水溶液)并分离层。
[0208]
实施例4,苯基辣椒素(1a)的结晶
[0209]
向实施例3所得的有机相中再次添加300ml水并将混合物在3℃冷却下搅拌5小时,得到沉淀的产物。晶体通过过滤分离并在过滤器上用130ml冷mtbe冲洗然后风干以提供1a为白色结晶物质。将所得的固体溶解在375ml mtbe中,随之蒸发溶剂以产生145g、81%产率的1a为浅棕色糖浆。1h nmr(dmso-d6)δ8.87(s,1h),8.26(t,1h,j=5.7hz),7.40-7.36(m,2h),7.35-7.31(m,3h),6.83(d,1h,j=1.7hz),6.73(d,1h,j=7.9hz),6.67(dd,1h,j=7.9,1.7hz),4.19(d,2h,j=5.7hz),3.73(s,3h),2.43(t,2h,j=7.0hz),2.20(t,2h,j=7.2hz),1.74-1.66(m,2h),1.59-1.51(m,2h);
13
c nmr(dmso-d6)δ172.0,147.5,145.5,131.3,130.6,128.6,128.0,123.4,119.8,115.3,111.6,90.5,80.8,55.5,42.0,35.0,27.9,24.8,18.5。c
21h24
no
3+
[m+h]
+
的hrms(esi)计算值为338.1756,实测值为338.1759。
[0210]
根据方案13中示出的路线合成capsaicyn 1b和1c。通过ms和/或nmr分析来鉴定产物。
[0211][0212]
方案13
[0213]
实施例5,7-氯-2,2-二甲基-3-庚炔(4b)的制备(步骤1)
[0214]
将3,3-二甲基-1-丁炔(7b)(3g,36.5mmol)溶解在27ml无水thf中,并将所得混合物冷却至-15℃。在40min期间逐滴添加在己烷中的1.6m丁基锂(22.83ml,36.5mmol),随之使混合物达到20℃ 2小时。添加1-氯-3-碘丙烷(6b)(6.35g,31.0mmol)并将混合物在20℃下搅拌3天,随之添加21ml水。去除底部水相,并将10ml水和1ml 25%hcl的混合物添加至有机相中。去除底部水相,并在减压下从有机相中蒸发溶剂,以得到黄色油状物(4b)(4.68g,29.5mmol),产率为95%。1h nmr(cdcl3)δ3.63(t,2h,j=6.5hz),2.31(t,2h,j=6.8hz),1.91(p,2h,j=6.6hz),1.18(s,9h);
13
c nmr(cdcl3)δ90.1,76.3,43.8,31.9,31.3,27.3,16.2。
[0215]
实施例6,(3b)(6,6-二甲基-4-庚炔基)丙二酸的制备(步骤2)
[0216]
混合7-氯-2,2,-二甲基-3-庚炔(4b)(4.12g,26.0mmol)、丙二酸二乙酯(5a)(6.24g,38.9mmol)、乙醇(12.6ml)和25%甲醇钠(7.01g,32.5mmol)。在70℃下将混合物加热3天。冷却后,将混合物用5.7ml水淬灭,并添加11.95g的28%(水溶液)氢氧化钠溶液,并在30℃下将反应混合物搅拌24小时。将反应混合物在真空下浓缩成半结晶物质并重新溶解在16ml水中。用10ml份的甲苯萃取混合物两次。向所得水相中添加16g 25%hcl,并用25ml份的mtbe萃取所得混合物两次。合并mtbe部分,并在减压下蒸发溶剂,以得到灰白色固体(3b)(5.26g,23.3mmol),产率为90%。
[0217]1h nmr(dmso-d6)δ3.21(t,1h,j=7.3hz),2.09(t,2h,j=7.2hz),1.78-1.72(m,2h),1.41-1.34(m,2h),1.12(s,9h);
13
c nmr(dmso-d6)δ171.2,89.6,78.4,51.6,31.6,28.1,27.4,26.8,18.2。c
12h17o4-[m
–
h]-的hrms(esi)计算值为225.1127,实测值为225.1126。
[0218]
实施例7,(1b)n-[(4-羟基-3-甲氧基苯基)甲基]-8,8-二甲基-6-壬炔酰胺的制备(步骤3)
[0219]
将(6,6-二甲基-4-庚炔基)丙二酸(3b)(1.0g,4.4mmol)溶解在5ml mtbe中并在气体析出下逐滴添加至羰基二咪唑(0.86g,5.3mmol)在5ml mtbe中的悬浮液中,并在40℃下将所得混合物加热一小时。将所得溶液添加至香兰素胺盐酸盐(2a)(1.01g,5.3mmol)的悬浮液中并在50℃下继续搅拌22小时,随之添加10ml水并在40℃下搅拌混合物直到形成两个透明相。分离底部水性层,并用10ml水和1ml 25%hcl的混合物洗涤有机相。将有机相用0.26g氢氧化钠和10ml水的溶液萃取,并然后进一步用5ml水洗涤。合并两个水相并添加0.6ml 37%hcl(水溶液)和10ml mtbe。去除所得水相,并用5ml水洗涤有机相。在减压下去除有机相中的溶剂,以得到黄色油状物(1b)(0.70g,2.2mmol),产率为50%。1h nmr(cdcl3)δ6.86(d,1h,j=8.0hz),6.79(d,1h,j=2.0hz),6.74(dd,1h,j=8.0,2.0hz),4.34(d,2h,j=5.6hz),3.86(s,3h),2.22(t,2h,j=7.5hz),2.15(t,2h,j=7.1hz),1.77-1.70(m,2h),1.54-1.46(m,2h),1.16(s,9h);
13
c nmr(cdcl3)δ172.7,146.7,145.1,130.2,120.8,114.4,110.7,89.4,77.8,55.9,43.6,36.2,31.4,28.6,27.3,24.9,18.4。c
19h28
no
3+
[m+h]
+
的hrms(esi)计算值为318.2069,实测值为318.2068。
[0220]
实施例8,5-氯-1-环己基-1-戊炔(4c)的制备(步骤1)
[0221]
将环己基乙炔(7c)(2.46g,22.7mmol)溶解在22ml无水thf中,并将所得混合物冷却至-15℃。在30min期间逐滴添加在己烷中的1.6m丁基锂(14.19ml,22.7mmol),随之使混合物达到20℃ 2小时。添加1-氯-3-碘丙烷(6b)(3.95g,19.3mmol)并将混合物在20℃下搅拌3天,随之添加17ml水。去除底部水相,并将10ml水和1ml 25%hcl的混合物添加至有机相中。去除底部水相,并在减压下从有机相中蒸发溶剂,以得到黄色油状物(4c)(3.35g,18.2mmol),产率为94%。1h nmr(cdcl3)δ3.63(t,2h,j=6.5hz),2.35-2.27(m,3h),1.91(p,2h,j=6.6hz),1.78-1.72(m,2h),1.70-1.62(m,2h),1.51-1.47(m,1h),1.41-1.33(m,2h),1.32-1.23(m,3h);
13
c nmr(cdcl3)δ85.7,77.8,43.8,33.1,31.9,29.1,25.9,24.9,16.2。
[0222]
实施例9,(5-环己基-4-戊炔基)丙二酸(3c)的制备(步骤2)
[0223]
混合5-氯-1-环己基-1-戊炔(4c)(1.97g,10.7mmol)、丙二酸二乙酯(5a)(2.56g,16.0mmol)、乙醇(6.0ml)和25%甲醇钠(2.88g,13.3mmol)。在70℃下将混合物加热2天。冷
却后,将混合物用2.7ml水淬灭,并添加4.77g的28%(水溶液)氢氧化钠溶液,并在30℃下将反应混合物搅拌24小时。将反应混合物在真空下浓缩成半结晶物质并重新溶解在40ml水中。用25ml份的甲苯萃取混合物两次。向所得水相中添加6.5g 25%hcl,并用25ml份的mtbe萃取所得混合物两次。合并mtbe部分,并在减压下蒸发溶剂,以得到灰白色固体(3c)(2.01g,8.0mmol),产率为75%。
[0224]1h nmr(cdcl3)δ3.48(t,1h,j=7.4hz),2.33-2.28(1h,m),2.23(dt,2h,j=6.9,2.2hz),2.09-2.03(m;2h),1.79-1.73(m,2h),1.70-1.64(m,2h),1.62-1.55(m,2h),1.52-1.46(m,1h),1.42-1.34(m,2h),1.30-1.24(m,3h)。
13
c nmr(cdcl3)δ174.6,85.7,78.5,51.1,33.0,29.1,27.8,26.6,25.9,24.9,18.4。c
14h19o4-[m
–
h]-的hrms(esi)计算值为251.1283,实测值为251.1286。
[0225]
实施例10,n-[(4-羟基-3-甲氧基苯基)甲基]-7-环己基-6-庚炔酰胺(1c)的制备(步骤3)
[0226]
将(5-环己基-4-戊炔基)丙二酸(3c)(1.0g,4.0mmol)溶解在5ml mtbe中并在气体析出下逐滴添加至羰基二咪唑(0.77g,4.8mmol)在5ml mtbe中的悬浮液中,并在40℃下将所得混合物加热一小时。将所得溶液添加至香兰素胺盐酸盐(2a)(0.90g,4.8mmol)的悬浮液中并在50℃下继续搅拌22小时,随之添加10ml水并在40℃下搅拌混合物直到形成两个透明相。分离底部水性层,并用10ml水和0.5ml 25%hcl的混合物洗涤有机相。将有机相用0.19g氢氧化钠和10ml水的溶液萃取,并然后进一步用5ml水洗涤。合并两个水相并添加0.43ml 37%hcl(水溶液)和10ml mtbe。去除所得水相,并用5ml水洗涤有机相。在减压下去除有机相中的溶剂,以得到黄色油状物(1c)(0.68g,2.0mmol),产率为50%。1h nmr(cdcl3)δ6.84(d,1h,j=8.0hz),6.79(d,1h,j=2.0hz),6.74(dd,1h,j=8.0,2.0hz),4.34(d,2h,j=5.5hz),3.86(s,3h),2.26-2.15(m,5h),1.78-1.62(m,6h),1.55-1.47(m,3h),1.36-1.21(m,5h);
13
c nmr(cdcl3)δ172.7,146.7,145.1,130.2,120.8,114.4,110.7,85.2,79.3,55.9,43.5,36.2,33.1,29.1,28.6,25.9,25.0,24.9,18.5。c
21h30
no
3+
[m+h]
+
的hrms(esi)计算值为344.2226,实测值为344.2226。
[0227]
说明性实施例
[0228]
说明性实施例i,n-(4-羟基-3-甲氧基)-十九-6-炔酰胺的制备
[0229]
将氢化钠(60%在矿物油中)悬浮在thf和十二烷基乙炔中,并添加dmso,随后添加1-溴-3-氯丙烷(6a),并在50℃下将所得混合物加热20小时。反应后,将混合物冷却并用0.5m hcl(水溶液)淬灭,随之暂停搅拌并分离两层。将庚烷添加至有机相中,并用水萃取所得混合物。蒸发所得有机相中的溶剂,以产生粗产物。通过在减压下短程蒸馏来纯化粗产物。
[0230]
将分离的中间体和丙二酸二乙酯(5a)溶解在乙醇中,随之添加甲醇钠(25%溶液在甲醇中)。在70℃下将混合物加热48小时。冷却后,用水淬灭混合物,并添加28%(水溶液)氢氧化钠溶液,并在30℃下搅拌反应混合物直到hplc分析示出酯完全转化为丙二酸衍生物3。将反应混合物在真空下浓缩成半结晶物质并重新溶解在水中。用甲苯萃取混合物两次。向所得水相中缓慢添加30%hcl,随之沉淀产物。在25℃下搅拌2小时后,将产物过滤,并用庚烷和水冲洗。风干所得丙二酸中间体。
[0231]
将丙二酸中间体溶解在mtbe中并逐滴添加至羰基二咪唑在mtbe中的悬浮液中,并
在25℃下搅拌30分钟,并且最后加热至40℃一小时以驱动反应完成。向混合物中添加香兰素胺盐酸盐并在45℃下继续搅拌20小时,随之添加水并在40℃下搅拌混合物直到形成两相。分离底部水性层,并在40℃下用水再次萃取有机相。分离后添加300ml水,随后添加15ml的hcl(30%水溶液)并分离层。向所得有机相中添加300ml水并分离层。向所得有机相中添加20g硫酸镁。搅拌并过滤混合物,并从所得滤液中蒸发溶剂以产生n-(4-十二烷基苄基)-7-苯基庚-6-炔酰胺。
[0232]
说明性实施例ii,n-(4-羟基-3-甲氧基苄基)-8-甲基壬-6-炔酰胺的制备
[0233]
将氢化钠(60%在矿物油中)悬浮在thf和3-甲基-1-丁炔中,并添加dmso,随后添加1-溴-3-氯丙烷(6a),并在50℃下将所得混合物加热20小时。反应后,将混合物冷却并用0.5m hcl(水溶液)淬灭,随之暂停搅拌并分离两层。将庚烷添加至有机相中,并用水萃取所得混合物。蒸发所得有机相中的溶剂,以产生粗产物。通过在减压下蒸馏来纯化粗产物。
[0234]
将分离的中间体和丙二酸二乙酯(5a)溶解在乙醇中,随之添加甲醇钠(25%溶液在甲醇中)。在70℃下将混合物加热48小时。冷却后,用水淬灭混合物,并添加28%(水溶液)氢氧化钠溶液,并在30℃下搅拌反应混合物直到hplc分析示出酯完全转化为丙二酸衍生物3。将反应混合物在真空下浓缩成半结晶物质并重新溶解在水中。用甲苯萃取混合物两次。向所得水相中缓慢添加30%hcl,随之沉淀产物。在25℃下搅拌2小时后,将产物过滤,并用庚烷和水冲洗。风干所得丙二酸中间体。
[0235]
将丙二酸中间体溶解在mtbe中并逐滴添加至羰基二咪唑在mtbe中的悬浮液中,并在25℃下搅拌30分钟,并且最后加热至40℃一小时以驱动反应完成。向混合物中添加香兰素胺盐酸盐并在45℃下继续搅拌20小时,随之添加水并在40℃下搅拌混合物直到形成两相。分离底部水性层,并在40℃下用水再次萃取有机相。分离后添加300ml水,随后添加15ml的hcl(30%水溶液)并分离层。向所得有机相中添加300ml水并分离层。向所得有机相中添加20g硫酸镁。搅拌并过滤混合物,并从所得滤液中蒸发溶剂以产生n-(4-羟基-3-甲氧基苄基)-8-甲基壬-6-炔酰胺。
[0236]
说明性实施例iii,n-(3-氟-4-甲氧基苄基)-7-苯基庚-6-炔酰胺的制备
[0237]
将氢化钠(60%在矿物油中)悬浮在thf和苯乙炔中,并添加dmso,随后添加1-溴-3-氯丙烷(6a),并在50℃下将所得混合物加热20小时。反应后,将混合物冷却并用0.5m hcl(水溶液)淬灭,随之暂停搅拌并分离两层。将庚烷添加至有机相中,并用水萃取所得混合物。蒸发所得有机相中的溶剂,以产生粗产物。通过在减压下蒸馏来纯化粗产物。
[0238]
将分离的中间体和丙二酸二乙酯(5a)溶解在乙醇中,随之添加甲醇钠(25%溶液在甲醇中)。在70℃下将混合物加热48小时。冷却后,用水淬灭混合物,并添加28%(水溶液)氢氧化钠溶液,并在30℃下搅拌反应混合物直到hplc分析示出酯完全转化为丙二酸衍生物3a。将反应混合物在真空下浓缩成半结晶物质并重新溶解在水中。用甲苯萃取混合物两次。向所得水相中缓慢添加30%hcl,随之沉淀产物。在25℃下搅拌2小时后,将产物过滤,并用庚烷和水冲洗。风干所得丙二酸中间体。
[0239]
将丙二酸中间体溶解在mtbe中并逐滴添加至羰基二咪唑在mtbe中的悬浮液中,并在25℃下搅拌30分钟,并且最后加热至40℃一小时以驱动反应完成。向混合物中添加3-氟-4-甲氧基苄胺并在45℃下继续搅拌20小时,随之添加水并在40℃下搅拌混合物直到形成两相。分离底部水性层,并在40℃下用水再次萃取有机相。分离后添加300ml水,随后添加15ml
的hcl(30%水溶液)并分离层。向所得有机相中添加300ml水并分离层。向所得有机相中添加20g硫酸镁。搅拌并过滤混合物,并从所得滤液中蒸发溶剂以产生n-(3-氟-4-甲氧基苄基)-7-苯基庚-6-炔酰胺。
- 一种木质素基丙烯酸树脂及其制...
- 一种测序芯片及应用其的单细胞...
- 一种用于PVC树脂的增韧助剂...
- 一种2-氯-N-(2,6-二...
- 纯化方法与流程
- 一种提高甜瓜蔓枯病病原菌分生...
- 解交联废弃乳胶增强增韧聚乳酸...
- 一种环氧改性有机硅树脂及其制...
- 一种超低能耗汽车内饰件及其生...
- 一种固固相变材料及制备方法和...
- 还没有人留言评论。精彩留言会获得点赞!